该课题组为提高GEN的生物利用率,提高其靶向性,制备了含有超氧化物歧化酶模拟物(Tempol)共轭的 β-环糊精和 4-(羟甲基)苯基硼酸频哪醇酯修饰的GEN的ROS响应型纳米材料(GEN-NP2)。该材料可以被肠上皮细胞摄取并在炎症部位ROS刺激下高效清除各种活性氧分子(图1)。另外GEN-NP2可以保护 GEN 免受胃肠道中消化酶的快速代谢,从而有效地将GEN 靶向递送至炎症部位(图2)。从机制上讲,GEN-NP2通过增加雌激素受体β(ERβ)的表达,降低促炎介质的表达,减弱炎症部位炎症细胞的浸润,促进肠上皮细胞的自噬,抑制炎性细胞因子的分泌,并调节肠道微生物群的稳态,最终缓解肠道炎症(图3,4)。本研究为 IBD 的精确治疗提供了一种有效的方案,为提高中药的生物利用度,治疗其它与氧化应激、炎症相关的疾病提供了思路。
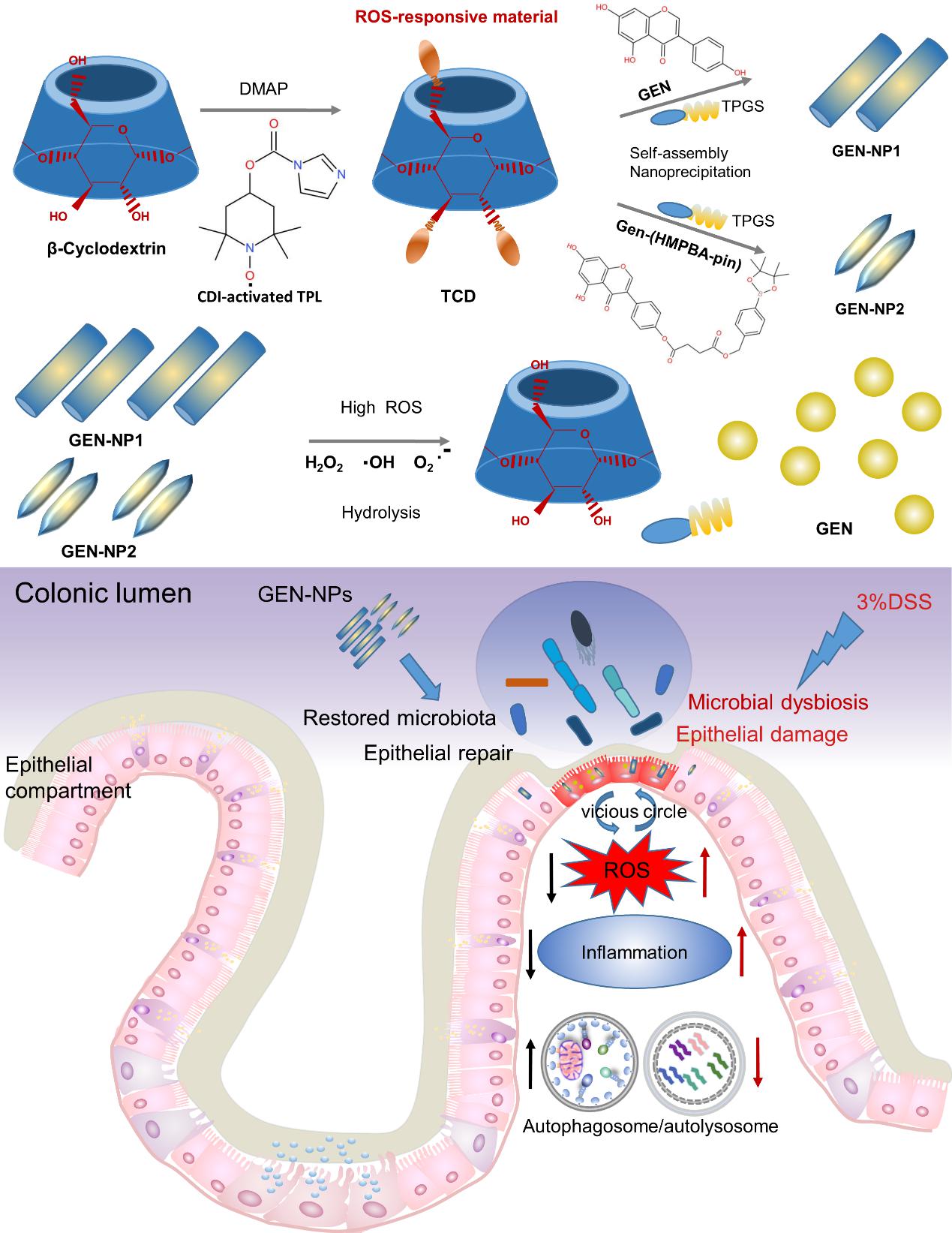

图 2. GEN-NPs 靶向定位于具有炎症反应的结肠。(A-D) 通过紫外可见光谱 (A和C) 和HPLC (B和D) 检测 SGF、SIF和SCF 中 GEN-NPs 的化学稳定性。(E) GEN在不同模拟缓冲溶液中从 GEN-NPs的释放曲线。(F) FITC标记的 GEN-NP1在健康或结肠炎小鼠中离体成像的生物分布分析。(G) 结肠中FITC-GEN-NP1荧光信号的量化。

图3. GEN-NPs 调节细胞中的自噬-炎症小体信号通路。(A) 使用蛋白质印迹分析 ASC、Caspase1-p20、ULK1、ATG16L1 和 ERβ 的表达水平。(B) ERβ二聚化的检测。(C) 细胞中的 EGFP-mCherry-LC3B(黄色)表达。(D)自噬相关斑点阳性细胞定量分析。

图4. GEN-NPs 对肠道微生物群的调节作用。(A) 粪便微生物群组成在属水平上的变化。(B) 不同处理组的肠道微生物群 α 多样性。(C) 不同处理组中微生物群落的香农指数。 (D) 代表性样品中微生物群组成的 NMDS 分析。
相关链接
https://pubs.acs.org/doi/pdf/10.1021/acsami.1c09215