肝癌是全球范围内发病率和死亡率均居高不下的恶性肿瘤之一。对于无法手术切除的中晚期肝癌患者,肝动脉灌注化疗(HAIC)因其能够在肿瘤局部实现高药物浓度,已成为重要的介入治疗手段。然而,传统 HAIC 仍面临持续留置导管、系统毒性、药物在肿瘤局部停留时间短等关键瓶颈,严重制约了疗效提升。如何在不引入额外载体材料的前提下,实现化疗药物在肿瘤血管内的精准滞留、持续释放与高效杀伤,一直是介入肿瘤治疗领域的核心挑战。
近期,苏州大学陈倩教授团队发现并提出了一种全新的解决策略:利用超声刺激,直接驱动化疗药物本身在体内原位自组装形成水凝胶(Mel-gel),从而显著提升 HAIC 的治疗效果与安全性(图1)。相关成果以“Ultrasound-driven in situ self-assembly of drug hydrogel for enhanced hepatic artery infusion chemotherapy”发表在 Materials Today 上。
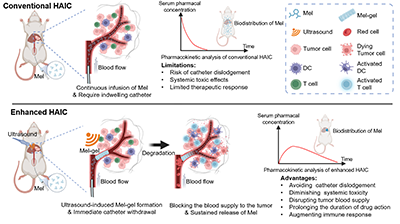
图1:超声驱动 Mel-gel 原位形成并增强肝动脉灌注化疗的示意图
文章要点:
研究团队以经典烷化类化疗药物Melphalan(Mel) 为研究对象,首次发现该小分子药物在超声作用下,无需任何化学修饰或外源载体,即可通过氢键与 π–π 相互作用快速从分散状态转变为纳米纤维网络,并在数秒内形成稳定的纯药物水凝胶(Mel-gel)(图2)。
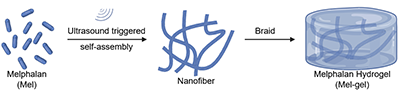
图2:超声诱导 Mel 分子从聚集体到纳米纤维水凝胶的形成过程
研究人员进一步将这一超声响应型药物水凝胶策略引入肝动脉灌注化疗过程:
在完成肝动脉插管后,仅需一次性注入Mel 悬液,并在肿瘤区域施加无创超声,即可在肿瘤供血血管内原位触发 Mel-gel 的形成。这种“边注射、边成胶”的策略带来了多重协同优势:快速形成局部药物仓库,显著延长药物在肿瘤区域的停留时间;短期阻断肿瘤血供,产生类似栓塞的缺血坏死效应;持续释放化疗药物,增强药物–肿瘤细胞相互作用;注射后可立即拔除导管,显著降低临床并发症风险。
更为重要的是,研究发现 Mel-gel 的持续释放特性能够显著诱导免疫原性细胞死亡(ICD),促进树突状细胞成熟、细胞毒性 T 细胞与 NK 细胞浸润,并在双侧肿瘤模型中观察到明显的远端效应(abscopal effect),显示出与免疫治疗联用的巨大潜力。
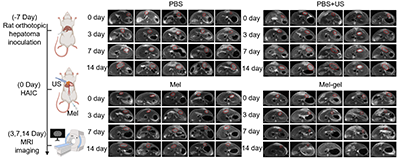
图3:Mel-gel 诱导的抗肿瘤显著治疗效果
除单一化疗药物外,研究团队还进一步证明,Mel-gel 可作为一种通用的体内原位缓释平台。无论是小分子药物(如 DOX)还是大分子蛋白(如 IgG),均可在 Mel-gel 中实现长达数周的稳定释放,并显著改善体内药代动力学与肿瘤富集能力。
该研究首次提出并验证了“纯药物原位水凝胶”用于介入治疗的新范式,在避免传统载体材料潜在风险的同时,为精准、微创、高效的肝癌治疗提供了全新思路。
原文链接:https://doi.org/10.1016/j.mattod.2025.12.006
- 东华大学李静超 Angew:半导体聚合物纳米反应器通过超声触发级联乳酸消耗用于胰腺癌铜死亡-免疫治疗 2024-05-07
- 浙江大学高长有教授团队 Mater. Horiz.:可原位自组装的形状记忆聚氨酯补片 - 用于组织微创递送和治疗 2023-06-30
- 同济大学杜建忠/范震团队《Adv. Funct. Mater.》:酶促自组装多肽纳米颗粒治疗细菌性感染伤口 2023-03-13
- 广东工业大学谭剑波-张力课题组《Macromolecules》: 基于RAFT分散聚合的分段超支化嵌段共聚物的合成和原位自组装 2022-07-07
- 南京理工傅佳骏/姚博文团队 Nat. Commun.:类神经、导电通路可重构的水凝胶基一体化电子电路用于人-机整合 2026-02-14
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 南京大学王炜/曹毅/薛斌团队 Nat. Commun.:仿生分级picot纤维水凝胶涂层实现超低摩擦与高耐磨性 2026-02-09
