细菌性脑膜炎对人类健康构成严重威胁,致死率高达54%。ESKAPE菌作为医院感染的主要原因,由于严重的多药耐药性和泛药耐药性,已被世界卫生组织定义为需要关键/高度优先应对的病原体。此外,血脑屏障(BBB)会阻止几乎100%的大分子和98%的小分子进入大脑,使脑膜炎的治疗尤为困难。因此,亟需开发新型抗菌药物应对这一全球公共卫生威胁。宿主防御肽(HDPs)及其模拟物因其不易诱导耐药性的优点,被视为极具前景的抗耐药菌感染候选药物,但常因广谱抗菌活性弱或无法穿透血脑屏障等问题,而难以用于细菌性脑膜炎治疗研究。因此,设计兼具高效抗ESKAPE活性和穿透血脑屏障性能的HDP模拟物,对于包括脑膜炎在内的ESKAPE感染治疗具有重要意义。
本研究中,刘润辉教授课题组提出“双胍可作为新型宿主防御肽模拟物侧链正电荷基团”的策略,基于双胍官能团高电荷密度与强磷脂结合力的特性,实现了双胍化聚合物对ESKAPE耐药菌的高效广谱破膜杀菌性能,且长期处理不会诱导细菌产生耐药性与交叉耐药性。基于此策略设计的双胍化多肽模拟物在皮肤伤口感染、皮下感染、肾脏感染和腹膜炎等多种动物感染模型中均展现出优异的治疗效果。更重要的是,双胍化多肽模拟物能够通过转胞吞穿透血脑屏障,有效治疗耐药细菌性脑膜炎。该研究为设计新型抗ESKAPE药物和治疗包括脑膜炎在内的耐药菌感染提供了创新策略。
2025年12月9日,该研究成果以“Biguanide-functionalized peptide mimics effectively combat drug-resistant ESKAPE pathogens and meningitis”为题发表在Nature Communications(Nat. Commun. 2025, DOI: 10.1038/s41467-025-67044-5)。刘润辉教授和武月铭副教授是论文的通讯作者。
宿主防御肽因其广谱抗菌活性和不易诱导抗菌耐药性的特点,已被广泛研究作为潜在的抗生素抗感染替代品。然而,宿主防御肽固有的局限性限制了其应用,如蛋白酶稳定性低、成本高和合成繁琐。因此,宿主防御肽模拟物已被广泛研究,旨在解决耐药细菌感染问题。然而,受到抗菌和穿透血脑屏障性能的限制,目前关于治疗细菌性脑膜炎的报道很少。宿主防御肽及其模拟物的侧链通常具有胺基或胍基阳离子基团,通过正电荷基团与带负电荷的细菌膜磷脂的初始相互作用,从而进一步发挥破膜抗菌活性(图1a)。然而,利用这两种基团一般难以实现高效抗ESKAPE活性和血脑屏障穿透能力的双功能活性。
在本研究中,刘润辉教授课题组提出双胍可作为宿主防御肽模拟物的一种新型正电荷基团。研究发现,双胍基的头部正电荷密度高于胺基和胍基,且平面、共轭阳离子结构使其能够同时向细菌膜磷脂的阴离子磷酸头部基团提供两个氢键(图1)。这种双位点结合产生了协同的静电相互作用和双齿氢键,能够显著增强膜结合亲和力与破坏效率。更高的局域正电荷密度也使基于双胍的分子能更有效地与血脑屏障的带负电荷内腔表面发生初始静电相互作用,从而可能通过吸附介导的胞吞作用增强其血脑屏障穿透效率。基于双胍的优选聚合物表现出出色的广谱抗ESKAPE活性和穿透血脑屏障性能,在包括脑膜炎在内的多种局部和全身感染动物模型中都展现出优异的治疗效果。

图1:设计兼具广谱抗ESKAPE活性和穿透血脑屏障性能的双胍化多肽模拟物。
本研究首先通过噁唑啉单体的聚合以及一步后修饰,得到了具有不同侧链间隔基的双胍化聚噁唑啉,并探究了一系列聚噁唑啉的抗ESKAPE活性和哺乳动物细胞以及血红细胞毒性。其中侧链间隔基为丙基的双胍化聚噁唑啉对几十株临床分离耐药ESKAPE均表现出高效抗菌活性,同时具有较好的生物相容性(图2)。此外,该优选双胍化聚噁唑啉能够有效清除更加耐药的持留菌和成熟生物被膜。
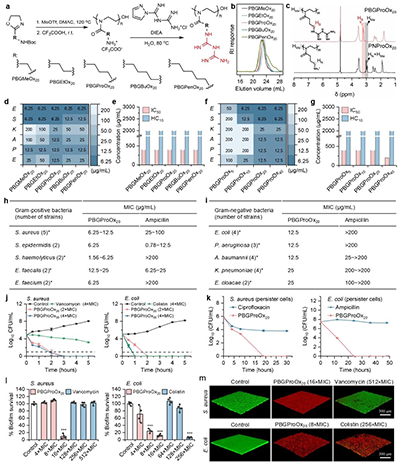
图2:双胍化聚噁唑啉的合成、表征和体外抗菌性能研究。
优选双胍化聚噁唑啉能够能够有效破坏细菌细胞膜,从而杀死细菌(图3)。通过对比氨基聚噁唑啉、胍基聚噁唑啉和双胍基聚噁唑啉对细菌细胞膜的影响,发现双胍化聚噁唑啉能够更加有效的造成膜去极化和膜电位紊乱,从而降低膜刚度,进一步扰乱细菌的内外pH平衡,导致关键的代谢功能障碍,特别是质子动力的耗散(图4)。通过ITC结合和紫外-可见光谱表征发现,双胍基相比于氨基和胍基对细菌细胞膜上带负电的磷脂酰甘油表现出更高的亲和力,且添加外源性磷脂酰甘油能够特异性的降低双胍化聚噁唑啉的广谱抗菌活性,这表明双胍化聚噁唑啉能够有效结合细菌膜上的磷脂酰甘油,从而达到破坏细菌细胞膜的目的。此外,双胍化聚噁唑啉能够选择性的破坏模拟细菌细胞膜的PG&PC大单层囊泡(LUVs),造成钾离子泄露,而对模拟哺乳动物细胞膜的PC大单层囊泡无影响,进一步验证了双胍化聚噁唑啉的高效选择性抗菌性能(图5)。

图3:双胍化聚噁唑啉的破膜抗菌机制。
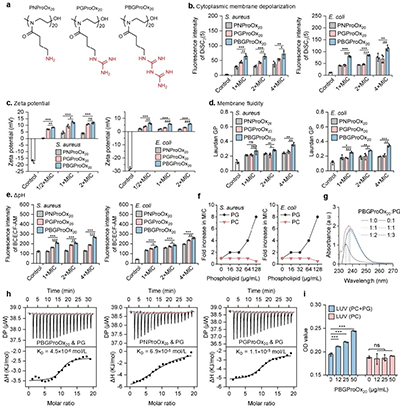
图4:双胍化聚噁唑啉对细菌细胞膜的影响。
对双胍化聚噁唑啉的耐药性发展进行了深入研究。结果显示,经过32代的持续刺激,金黄色葡萄球菌和大肠杆菌均未对双胍化聚噁唑啉产生任何耐药性(图5)。相比之下,在相同条件下的抗生素对持续刺激后的细菌产生了高达512倍的耐药性增长。此外,双胍化聚噁唑啉刺激后的细菌并未对各类传统抗生素产生交叉耐药性,而抗生素刺激后的细菌对其他抗生素表现出了广泛的交叉耐药。通过对长期刺激后的细菌进行RNA-SEQ分析,发现双胍化聚噁唑啉相比于抗生素,导致了更少的差异表达基因表达,甚至能够抑制细菌外排相关基因表达,表明具有破膜抗菌机制的双胍化聚噁唑啉具有极低的耐药性风险,远远优于临床抗生素。

图5:双胍化聚噁唑啉的耐药性发展与RNA-SEQ分析。
双胍化聚噁唑啉在多种耐药细菌感染模型中展现出出色的体内抗菌疗效。在皮肤伤口模型和皮下脓肿模型中,双胍化聚噁唑啉能够有效的降低感染部位的菌落复合,疗效与万古霉素等抗生素相当甚至略优(图6)。在肾脏感染模型中,双胍化聚噁唑啉使肾脏细菌负荷降低超过2个对数级,并能有效缓解肾脏病理损伤。在金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌和鲍曼不动杆菌诱导的致死性腹膜炎模型中,单次注射双胍化聚噁唑啉即可将感染小鼠的存活率提升83%~100%,且在主要器官、血液和腹腔液中实现最高7个对数级的细菌清除,显著缓解各器官病变。这些结果显示双胍化聚噁唑啉在局部和全身性感染动物模型中均具有明显治疗效果,与临床一线抗生素相当,为耐药微生物感染治疗提供了新的解决方案(图7)。

图6:双胍化聚噁唑啉的体内抗菌活性研究。

图7:双胍化聚噁唑啉治疗腹膜炎模型疗效研究。
双胍化聚噁唑啉能够通过巨胞饮作用和网格蛋白介导的内吞来有效穿透组成血脑屏障的脑内皮细胞,从而分布在胞内溶酶体中,并进一步被胞吐出胞外,这一连续的转胞吞行为使得双胍化聚噁唑啉在模拟血脑屏障的体外transwell模型中表现出高效的转运率,证明了穿透血脑屏障的潜力(图8)。进一步的体内研究表明,双胍化聚噁唑啉能够有效穿透小鼠和斑马鱼的血脑屏障,从而分布在脑部区域发挥作用。在细菌性脑膜炎模型中,双胍化聚噁唑啉可有效提高感染小鼠的存活率,并降低脑部的菌落复合以及炎症发现,高效治疗脑膜炎(图9)。此外,小鼠对双胍化聚噁唑啉的最大耐受剂量可达到300mg/kg,并且几乎不影响小鼠体重和各项血液生化指标等参数,表现出优秀的体内安全性。本研究为研发高效抗耐药菌和穿透血脑屏障的宿主防御肽模拟物提供了新思路。
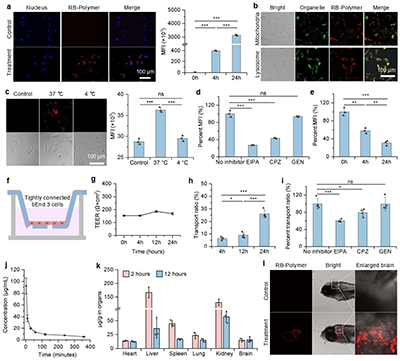
图8:双胍化聚噁唑啉穿透闹内皮细胞和血脑屏障研究。

图9:双胍化聚噁唑啉治疗细菌性脑膜炎疗效和安全性研究。
该研究得到了国家重点研发计划、材料生物学与动态化学教育部前沿科学中心等基金的资助。
论文链接:https://www.nature.com/articles/s41467-025-67044-5
- 东华大学朱美芳教授、贾超副研究员等 AFM:抗菌、制冷多功能聚乙烯纤维防护材料 2026-01-06
- 浙大张庆华教授团队 AFM:定制化多功能Janus织物 - 实现透气、抗菌与舒适个人热湿管理 2025-11-19
- 南京林业大学邓超/喻照川 AFM:纤维素基智能绷带实现感染动态监测与自调控抗菌治疗 2025-11-01
- 华东理工刘润辉教授课题组《CCS Chem.》:β-NNTA开环聚合实现温和条件下β类肽可控合成 2022-05-26
- 西南交大黄楠/杨志禄教授、江苏大学潘国庆教授和香港理工赵昕教授合作:可生物点击的贻贝仿生多肽用于血管支架的表面功能化的研究 2020-07-02
- 华东理工大学刘润辉教授《德国应用化学》:发展新型多肽模拟物研究领域重要突破并展示治疗耐药菌感染潜力 2020-02-23
