骨质疏松已成为老龄化社会严峻的公共健康问题,尽管治疗骨质疏松的纳米药物已经取得了显著效果,但是静脉注射后的纳米药物大部分会被肝脏截留吸收,这是纳米药物递送领域面临的普适性难题,导致到达骨骼部位并发挥作用的药物量较少,大大降低了药物的生物利用度。基于以上科学问题,山东大学化学与化工学院崔基炜教授团队联合山东大学齐鲁医院骨科刘新宇教授团队开发了一种负载药物的靶向脂质体(TLipAM),通过靶向递送药物和调控肝-骨轴双重机制,大大提高了药物利用度,实现了骨质疏松的有效治疗。该策略另辟蹊径,将非特异性富集在肝脏部位的纳米药物变废为宝,为纳米药物治疗提供了新思路。该工作以“Integration of Bone-Targeted Delivery and Crosstalk Modulation of Liver-Bone Axis for Improved Osteoporosis Therapy”为题发表在ACS Nano上。山东大学齐鲁医院刘新宇教授、王连雷教授、高至亮副研究员和化学与化工学院崔基炜教授为该论文的共同通讯作者,山东大学博士后尤云昊为论文的第一作者。
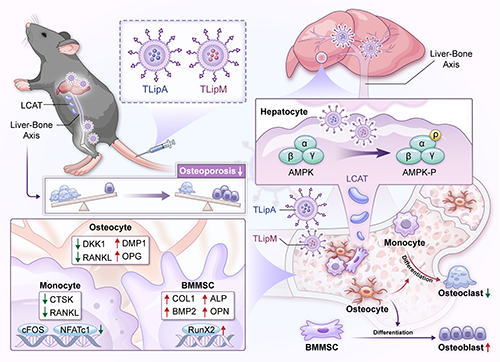
图1. TLipA和TLipM可靶向骨组织递送精氨酸和二甲双胍,而在肝脏部位非特异性富集的脂质体通过调节肝-骨轴促进成骨作用并抑制破骨细胞生成。
该团队开发了一种载有精氨酸和二甲双胍的靶向脂质体(TLipA和TLipM)用于治疗骨质疏松症。一方面,修饰了阿伦磷酸的脂质体可以有效靶向骨组织,调节骨髓间充质干细胞、破骨细胞和成骨细胞,促进成骨的同时抑制破骨;另一方面,脂质体在肝脏中的非特异性富集增强了卵磷脂胆固醇脂酰转移酶(LCAT)的分泌,而LCAT可以通过肝-骨轴调控成骨并抑制骨吸收,从而重新利用了肝脏部位非特异性富集的纳米药物。通过体内和体外实验,这种靶向递送和肝-骨轴调控的双重机制能够协同增强成骨并抑制破骨细胞的生成,在骨质疏松症动物模型中具有显著的治疗效果。该团队所报道的方法提高了纳米药物的生物利用度,对推动骨质疏松症的治疗具有重要意义。另外,该策略提供了一种利用不同器官之间的相互作用来增强纳米药物治疗的新范式,对治疗骨质疏松症和其他疾病具有广泛的借鉴意义。
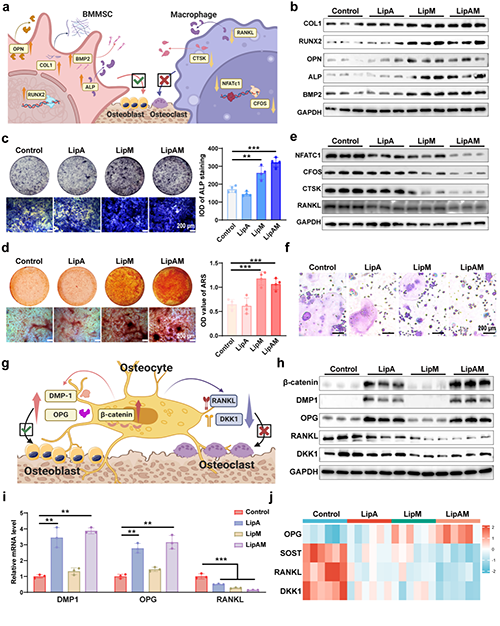
图2. LipAM通过促进成骨分化和抑制破骨分化,调节骨细胞功能从而促进骨平衡向成骨方向发展。
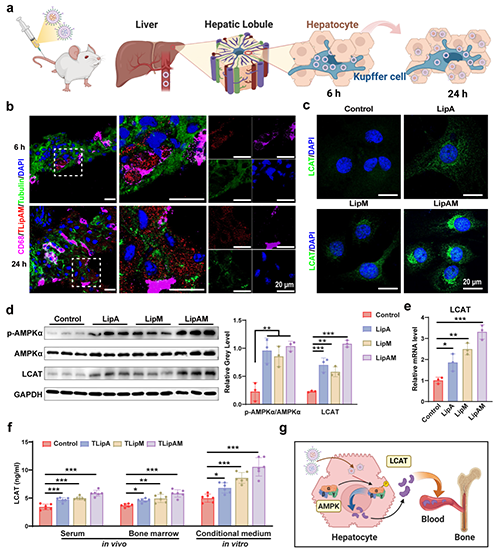
图3. TLipAM在肝脏中的非特异性富集增强了LCAT的分泌。
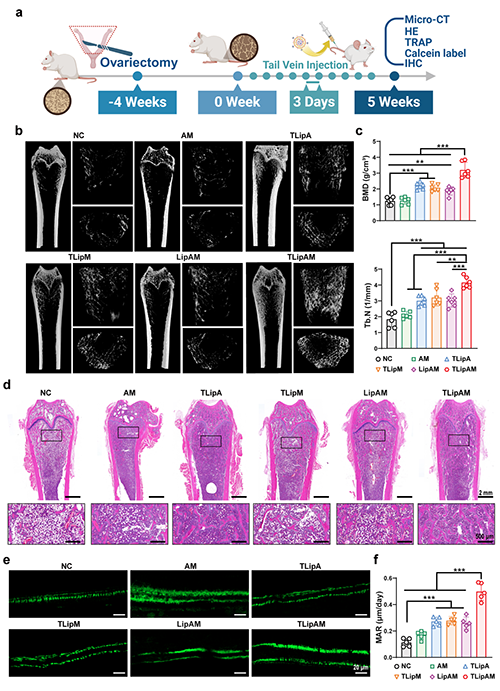
图4. TLipAM有效解决了骨质疏松模型大鼠的骨质流失。
上述研究工作得到了国家自然科学基金、山东省自然科学基金的资助和支持。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.5c05460
- 长春应化所陈学思/宋万通团队《Mater. Horiz.》:基于聚氨基酸的脾靶向递送mRNA的磷脂酰聚合物文库 2024-04-03
- 山东大学崔基炜教授 Nano Today:原位中性粒细胞“搭便车”策略用于肿瘤术后化疗-免疫联合治疗 2023-12-28
- 浙江大学高建青教授课题组《Adv. Funct. Mater. 》:在干细胞膜仿生囊泡多功能化和靶向递送上取得新进展 2020-09-22
- 山东大学崔基炜/王连雷教授《ACS Nano》:骨“创可贴”用于骨质疏松性骨折修复 2025-12-07
- 山东大学崔基炜教授团队 AFM:复合水凝胶通过免疫调控促进骨质疏松性骨折修复 2025-11-14
- 广医三院周蕾、广工谭帼馨 Nat. Commun.:可注射镁-双磷酸盐MOF基骨粘合剂通过抑制过度纤维化促进骨质疏松性骨折愈合 2025-07-07
