口服降糖药作为2型糖尿病(T2DM)临床管理的一线方案,凭借其用药便捷、治疗成本低和无创给药等核心优势,在超过60%患者的血糖调控中发挥关键作用。然而,现有口服降糖制剂普遍存在药代动力学特征不理想的问题,以磺脲类药物(如格列本脲)为代表的口服降糖药,因其非线性吸收特性和代谢个体差异,易引发剂量相关性低血糖事件,带来严重的治疗安全隐患。因此,优化口服降糖药的药代动力学特性以降低低血糖风险,对提升糖尿病治疗安全性和患者生活质量具有重要临床价值,仍是当前药物研发领域的难点之一。
近期,南京林业大学森林食物资源挖掘与利用全国重点实验室黄超伯教授和中国科学院宁波材料所海洋关键材料全国重点实验室陈涛研究员,受单细胞藻类螺形扁藻(Phacus helicoides)螺旋启发,开发了一种基于微流控技术的内部螺旋球体(HSs)制备策略(图1)。该研究通过设计新型微流控装置,实现了Fe?O?纳米颗粒在球体内部的螺旋分布,赋予HSs在外部磁场调控下同步自旋与圆周运动的协同驱动能力并实现高效混合;进一步负载葡萄糖氧化酶(GOD)与格列本脲(GLIB)后,HSs兼具吸附、催化葡萄糖氧化及pH响应释放药物的三重功能。在2型糖尿病大鼠模型中,HSs治疗后餐后2小时血糖水平从峰值降至正常水平,且低血糖事件发生率由传统给药方式的14.2-18.6%显著降低至3.8%,改善了磺脲类药物剂量相关性低血糖风险难题。
2025年6月16日,相关成果以“Bioinspired Heterogeneous Spheres with Tunable Helical Structure for Accurate and Efficient Control of Sugar Blood Level”为题,发表在Advanced Materials上(Adv. Mater. 2025, 2504878. DOI: 10.1002/adma.202504878)
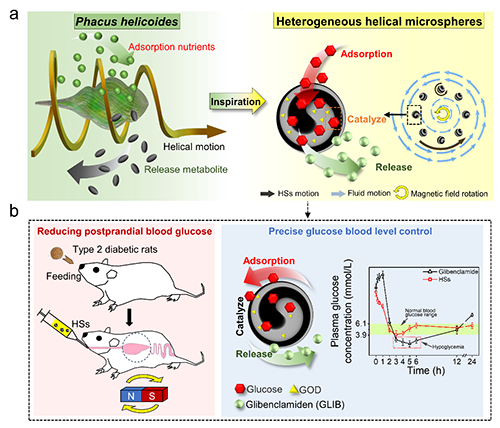
图1 螺旋藻启发的具有可调内部螺旋结构的异质球体,用于准确有效地控制血糖水平
研究团队通过自制的模块化水凝胶球体制备装置(图2a)生成螺旋球体(HSs),该装置包含流体供应模块(可调流速)、微通道模块(可调角度与直径)、液滴生成模块(可调高度)及球体成型模块(可调CaCl2浓度与转速)。将含的海藻酸钠(SA)溶液与含Fe3O4纳米颗粒的SA溶液分别泵入微通道,两股非牛顿流体因扭矩力作用形成Fe3O4螺旋分布的液滴(图2b);随后液滴落入接收浴中与Ca2+交联固化成球,最终获得内部纳米颗粒呈螺旋排列的HSs(图2c)。此外,可以通过调整各个模块的制备参数精细调控HSs的螺旋角及尺寸(图2d-e)。表明球体内部的螺旋结构的可调性,为后续功能优化奠定了关键基础。
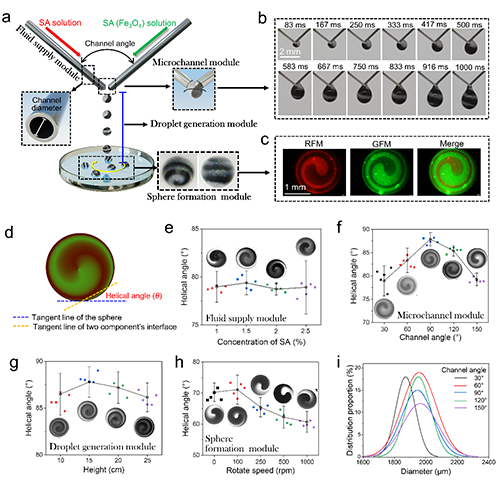
图2 基于新型微流控装置制备内螺旋结构可调的HSs
如图3a所示,他们观察到,在外部旋转磁场下,HSs可以同时自旋转和圆周运动。如图3b和3d所示,在外部旋转磁场下,HS-30、HS-60和HS-90在水中完成一次完整的自旋分别需要528±66、474±71和381±56 ms,他们还比较了同一时间段内球体圆周运动的程度(图3e)。结果表明,螺旋角越大,自旋速度越快,圆周运动速度越慢。为了更好了解HSs的混合能力,他们使用计算流体力学(CFD)来模拟溶剂中的流速和湍流(图3f)。此外,他们通过将500 μL彩色水溶液与10 mL甘油混合来证明HSs的混合能力(图3g)。并通过测试均匀混合次数,定量分析混合能力(图3h)。最后,研究了在有磁场和无磁场下HSs的细胞相容性和血液相容性(图3i-k)。
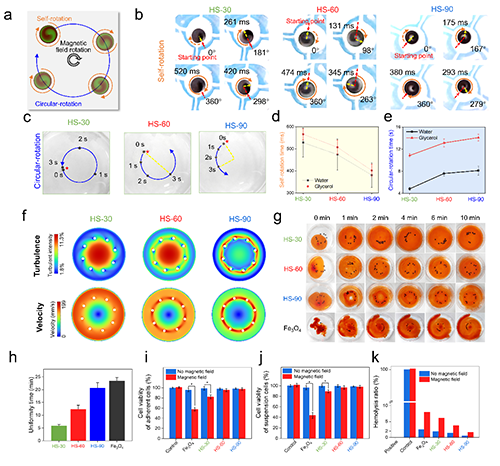
图3 HSs的微混合性能表征。
HSs不仅可以模拟螺旋螺旋体的旋转运动,还可以模拟螺旋螺旋体的代谢过程,包括吸附、催化和释放能力(图4a)。在磁场的驱动下,HSs可以同时进行旋转和圆周旋转,并吸收葡萄糖。图4b展示了HSs吸附水溶液中的葡萄糖性能。并通过添加葡萄糖催化剂,包括金属催化剂(TiO, ZnO),酶催化剂(葡萄糖氧化酶(GOD))和细菌(金黄色葡萄球菌),研究了HSs的催化能力(图4c-g)。此外,还对HSs的释放能力进行了研究(图4h-j)。
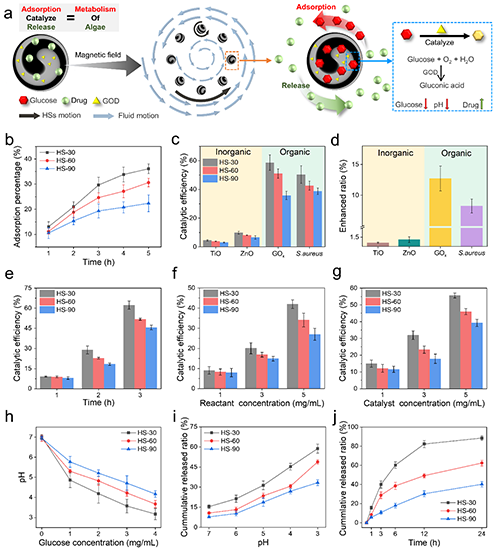
图4 HSs在磁场中的吸附、催化和释放能力
控制餐后血糖水平是治疗糖尿病的关键因素。2型糖尿病大鼠喂养后给予格列本脲、含葡萄糖氧化酶的HSs(HSs /GOD)、含GLIB的HSs(HSs/GLIB)、含GOD和GLIB的HSs(HSs/GOD/GLIB)以控制血糖(图5a)。图5f展示了治疗7天后,通过测试胰岛素抵抗稳态模型(HOMA-IR)来研究不同组的胰岛素敏感性。同时记录不同样品处理后糖尿病大鼠的体重变化(图5c)。最后,通过观察重要器官(如肺、肝、脾、肾和心脏)的HE染色图像来评估体内生物相容性。如图5h所示,实验组与对照组之间无明显差异,说明HS/GOD/GLIB在有无磁场作用下均具有良好的生物相容性。
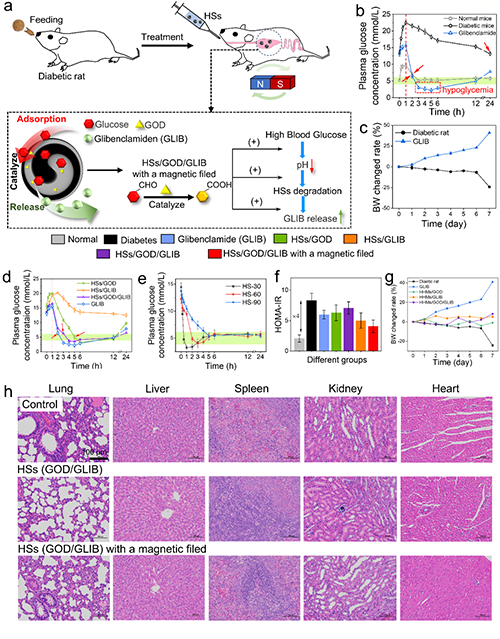
图5 口服HSs降低2型糖尿病大鼠餐后血糖。
第一作者为南京林业大学森林食物资源挖掘与利用全国重点实验室博士研究生袁康瑞,共同第一作者为南京林业大学机械电子工程学院贾志成讲师;文章的通讯作者为南京林业大学森林食物资源挖掘与利用全国重点实验室黄超伯教授及中国科学院宁波材料所海洋关键材料全国重点实验室陈涛研究员;特别致谢中山大学第五附属医院彭欣副研究员及比利时根特大学StefaanC. De Smedt院士在研究过程中给予的指导与帮助。该成果得到了国家自然科学基金项目资助。
论文全文链接:https://doi.org/10.1002/adma.202504878
中比先进生物医用材料联合实验室介绍:https://www.x-mol.com/groups/nfu-ugent
中国科学院宁波材料所智能高分子材料团队介绍:https://smartpolymers.nimte.ac.cn
- 浙江大学顾臻教授、王金强研究员团队 Nat. Nanotechnol.:创制血糖响应性胰岛素口服制剂 2024-09-03
- 浙大王立教授和俞豪杰副教授团队 ACS AMI:用于模拟一日三餐血糖控制的葡萄糖响应纳米粒子及其微针贴 2023-07-08
- 国科大温州研究院王毅团队和东华大学李召岭团队 Nano Energy:一种基于石墨烯纤维无纺布的高灵敏度透气电极用于无创血糖监测 2022-01-05
- 湘潭大学王秀锋教授 Lab Chip:基于热反馈实现个性化水合管理的皮肤可贴合微流控技术 2024-11-02
- 湘潭大学王秀锋/宾州州立程寰宇 Adv Sci:用于汗液定量分析的皮肤可贴合双流体纸基微流控技术 2024-02-04
- 川大张兴栋院士团队王启光/樊渝江 AM:靶向软骨细胞的可注射在体FGF18基因编辑和自润滑杂化外泌体微凝胶用于骨关节炎治疗 2024-01-29
