
溃疡性结肠炎(UC)作为一种慢性、易复发的肠道疾病,因无法治愈,被称为“绿色癌症”。传统治疗方法,如氨基水杨酸、皮质类固醇等,虽能一定程度上缓解症状,但存在诸多局限,包括副作用显著、高复发率以及难以根治等问题。而新兴的活菌疗法(LBT)虽然为UC治疗带来了新希望,却又面临细菌在胃肠道存活率低、难以长期定植以及治疗目标不明确等挑战。利用功能元件对生物体进行外源调控从而强化其结构和功能是一种新兴的生物体智能强化策略。前期,朱伟教授课题组围绕这一策略开展了大量研究工作(Angew. Chem. Int. Ed. 2024, 63, e20240611; Adv. Sci. 2024, 11, 2305126;ACS Nano 2022, 16, 2164-2175;Nat. Commun. 2022, 13(1), 6265;Adv. Funct. Mater., 2021, 31(10): 2005935;J. Am. Chem. Soc. 2021, 143, 17, 6305;ACS Nano 2020, 14, 7, 7847–7859等)。然而由于缺乏明确定义的治疗靶点,LBT的发展和临床应用仍然受到阻碍,这削弱了治疗效果的特异性和稳健性,并继续阻碍其发展和应用。此外,当前LBT研究主要通过调节菌群组成(促进有益菌、抑制有害菌)来实现从“不健康”到“健康”状态的转变。相较于广泛调节,靶向调控特定肠道细菌(旨在重建或优化肠道微生态平衡)为解决疾病机制提供了更精准的途径。尽管相关研究有限,但靶向消除UC相关病原体及对菌群进行动态、精确调控,有望提升治疗相关性和有效性,对改善患者临床症状及生活质量意义重大。
为此,朱伟教授团队创新性地提出了一种基因与化学协同工程化益生菌的策略,用于精准调节肠道菌群,推动LBT在UC治疗领域的技术发展和临床转化。该策略巧妙结合基因工程与化学改性,使益生菌摇身一变成为能在肠道内长期定植并持续发挥作用的“超级细胞工厂”和“特洛伊木马”战士,使其在肠道中高效调节肠道菌群和炎症反应,有望为UC治疗带来新突破。具体而言,该研究旨在验证两项核心创新概念:(1)利用外源强化策略增强口服细菌的功效;(2)通过基因工程实现更高效的肠道菌群调控。作者选择大肠杆菌 Nissle 1917(EcN)作为模型菌株,运用生物和化学工具对其进行两项关键改造,构建出 EcN::mcmA@P/O 菌株:(1)基因重编程以实现抗菌肽 MccM 的持续产生;(2)采用聚电解质复合涂层进行封装。
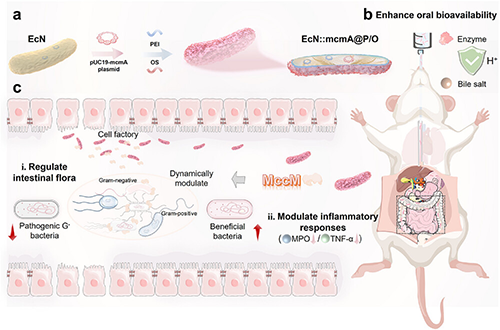
图1. 通过化学与合成生物学的协同作用增强益生菌治疗UC 策略。a) EcN::mcmA@P/O制备流程。b)化学修饰增强环境耐受性:可控的表面修饰强化工程菌外源功能,提升其在口服递送中对胃肠道极端环境的适应性。C) 原位精准调控:工程菌原位合成抗菌肽动态、准确地调节肠道微生态,抑制炎症反应。
双重工程框架赋予工程化益生菌两大优势:
1)外源强化显著增强细菌耐受 — 利用氧化淀粉(OS)的物理屏障效应和聚乙烯亚胺(PEI)的亲质子效应,通过静电/氢键作用一步法开发出聚电解质复合涂层。聚电解质涂层并没有改变EcN固有的生物学特性,但显着增强了其耐受胃肠道极端环境的能力,从而提高了口服利用效率(图2)。
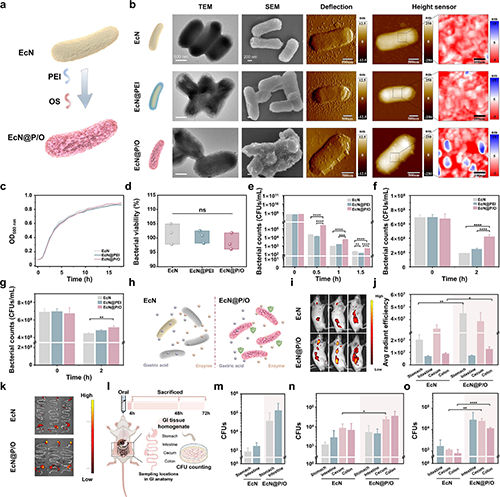
图2. ECN的化学工程.
2)内源改造强化病原体拮抗和炎症调节 — 益生菌的基因工程改造旨在杀菌剂的局部表达,增强药物靶向性并最大限度地减少副作用,同时利用其天然能力定植肠道和调节免疫反应,以进一步提高治疗效果。与 EcN 相比,EcN::mcmA 表现出增强的免疫调节功能和抗菌活性(图3)。

图3. ECN 的基因工程。
双重改性解锁“超级细胞工厂”“特洛伊木马” 之力:(图4)。 聚电解质涂层改性的 EcN::mcmA@P/O 可在胃肠道极端环境中稳定存在,化身 “超级细胞工厂”,持续原位生产杀菌剂 MccM 。MccM 通过“特洛伊木马”机制作用于细菌外膜的 TonB 受体,破坏细胞膜完整性,致使细菌死亡。由于 UC 患者与健康对照者粪便微生物群的主要区别在于革兰氏阴性(G?)细菌,而此类细菌细胞壁和外膜较薄,对MccM更为敏感。EcN::mcmA@P/O 具有卓越的菌群、免疫调节能力,mccM 的过表达强化了益生菌的菌群调节功效,聚电解质复合涂层则进一步放大了这一优势。
在葡聚糖硫酸钠(DSS)诱导的小鼠UC模型中,EcN::mcmA@P/O的口服干预有效重塑了小鼠肠道菌群,显著减轻炎症反应并恢复微生态平衡。此外,该平台的技术优势不仅体现在疗效上,其基因回路的模块化设计便于替换抗菌剂,可适应不同物种特异性抗菌靶标,从而实现定制化治疗应用。该研究为 UC 治疗开辟了新的路径,同时为未来基于工程益生菌的精准医疗提供了宝贵借鉴。
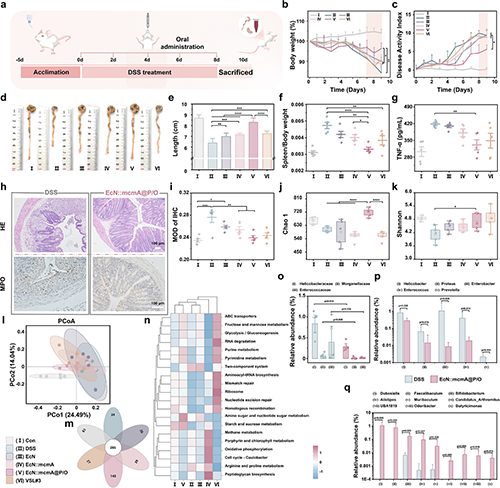
图4. EcN::mcmA@P/O 对DSS诱导的小鼠UC的治疗效果。
以上相关成果以“Synergistic Genetic and Chemical Engineering of Probiotics for Enhanced Intestinal Microbiota Regulation and Ulcerative Colitis Treatment”为题发表于《Advanced Materials》上,该论文共同第一作者为华南理工大学生物科学与工程学院博士研究生江佳妮和马毅副教授,通讯作者为华南理工大学生物科学与工程学院朱伟教授和中南林业科技大学林亲录教授、李江涛副教授。该研究得到了国家自然科学基金等项目支持。
原文链接:https://doi.org/10.1002/adma.202417050
- 四川大学吴宏教授、郭少云教授团队 CEJ:“静电-配位”涂层制备新策略助力实现全天候多场景个人热管理 2024-01-22
- 暨大刘明贤教授团队 Nano Today: 含有多酚@埃洛石的海藻酸盐微球用于益生菌递送和炎症性肠病治疗 2025-02-19
- 中山大学贾昭君课题组 AHM: “装甲”活体益生菌平台 - 糖尿病感染伤口愈合的创新解决方案 2025-01-25
- 四川大学张兴栋院士团队王启光/樊渝江 ACS Nano:益生菌膜囊泡锚定水凝胶用于大面积伤口的血管新生与修复 2025-01-21
- 中国农业科学院麻类研究所侯春生研究员团队 ACS Nano:黄麻纳米纤维素精准调控肠道菌群,重建微塑料损伤的肠道微生态平衡 2025-07-04
- 国家纳米科学中心查瑞涛、南方科技大学蒋兴宇 ACS Nano:纳米微晶纤维素通过调控肠道屏障治疗溃疡性结肠炎 2023-09-26
- 武汉大学张先正教授团队《Adv. Mater.》:基于梯度水凝胶的体外肠道菌群模型用于指导药物剂型的优化 2023-04-11
