骨关节炎(OA)是以软骨退化、滑膜炎症和骨赘形成为特征的慢性退行性关节疾病。滑膜巨噬细胞在OA的滑膜区尤其丰富且具有显著的可塑性,可根据不同的局部微环境分化为M1或M2表型以参与OA进展。M1型滑膜巨噬细胞通过加重炎症反应和氧化应激,直接损伤软骨组织或诱导软骨细胞凋亡。相反,M2型巨噬细胞通过产生抗炎细胞因子来缓解炎症并促进组织修复。因此,如何实现巨噬细胞表型极化和抗氧化的重编程是治疗OA的关键策略。
线粒体自噬功能障碍的巨噬细胞无法清除受损的线粒体,导致大量活性氧的积累,维持巨噬细胞M1表型的持续存在。采用槲皮素(Que)靶向滑膜巨噬细胞,促进线粒体自噬来恢复线粒体功能稳态是一种调控巨噬细胞行为的可行性策略,但其存在水溶性差、半衰期短、药效不持久、生物利用度低等问题。另一方面,OA患者关节部位对氧气的过度消耗会迫使巨噬细胞在适应乏氧微环境时优先使用糖酵解代谢途径,这也是驱动巨噬细胞向M1表型极化的重要原因,因此缓解乏氧来调控巨噬细胞表型同样具有应用潜力。过氧化氢酶(CAT)可以通过直接催化M1巨噬细胞中过度积累的过氧化氢转为氧气来补充炎症部位对氧气的消耗,然而酶作为一种蛋白类大分子,存在细胞膜渗透性差、易被降解、体内生物利用度较低等亟待解决的问题。
纳米技术的发展为解决酶和化疗药物递送问题提供了重要的解决方案。具有精确分子量分布和三维刚性结构的含磷树状或树冠大分子已发展成为药物或蛋白质的载体。重要的是,以羟基或亚磷酸钠末端的含磷树状大分子由于其固有的免疫调节活性,既可以作为递送载体,也可以作为治疗药物。因此,构建基于含磷树状大分子的纳米平台有望将线粒体自噬诱导剂与缓解乏氧的天然酶进行有机结合,提升药物和酶的生物利用度,用于重编程巨噬细胞进而调控成骨免疫微环境实现骨关节炎的综合治疗。
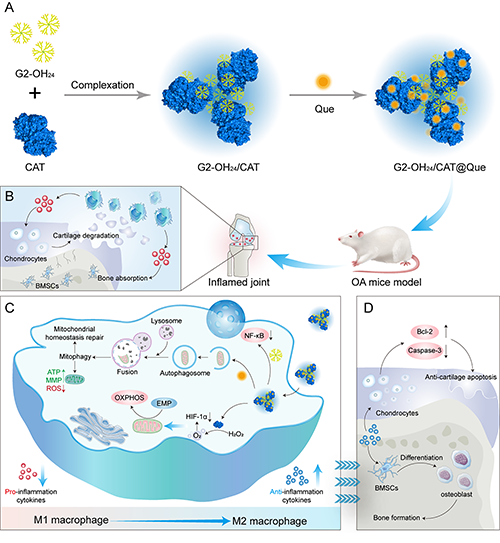
图1. G2-OH24/CAT@Que的制备和治疗机制示意图。
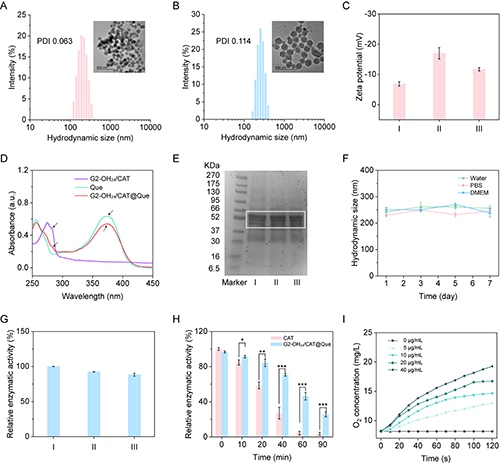
图2.(A)G2-OH24/CAT和(B)G2-OH24/CAT@Que的水合粒径分布图和TEM图像;不同材料的(C)表面电势、(D)UV-Vis图谱和(E)SDS-PAGE图谱;(F)G2-OH24/CAT@Que在不同分散体系中一周内的水合粒径尺寸变化;(G)不同材料的酶活性;(H)G2-OH24/CAT@Que与蛋白酶K孵育不同时间后的相对酶活力;(I)不同浓度下G2-OH24/CAT@Que的氧气产生能力。在图C、E和G中,Ⅰ是CAT;Ⅱ是G2-OH24/CAT;Ⅲ是G2-OH24/CAT@Que。
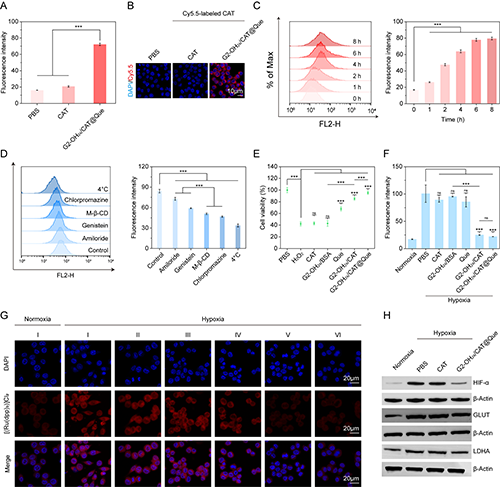
图3.(A-B)G2-OH24/CAT@Que促进CAT细胞内递送的流式定量图和CLSM图像;(C)RAW264.7细胞与G2-OH24/CAT@Que共孵育不同时间后细胞内荧光强度的流式细胞图;(D)不同内吞抑制剂预处理的细胞与G2-OH24/CAT@Que培养后细胞内荧光强度的流式定量结果;(E)不同材料预处理的细胞与过氧化氢共孵育24小时后的细胞活力;(F-G)不同材料处理后的RAW264.7细胞中氧气水平变化的流式定量结果和CLSM图像;(H)WB分析不同材料处理后细胞中相关标志蛋白的表达水平。在图G中:Ⅰ是PBS;Ⅱ是CAT;Ⅲ是G2-OH24/BSA;Ⅳ是Que;Ⅴ是G2-OH24/CAT;Ⅵ是G2-OH24/CAT@Que。
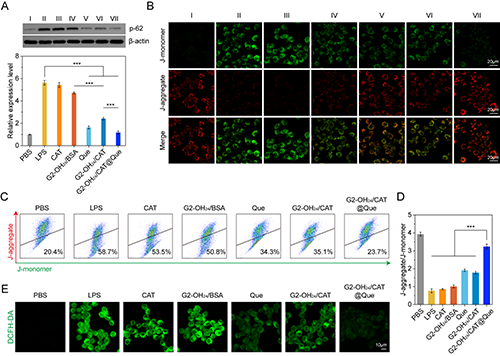
图4.(A)WB检测不同处理后细胞内p-62的表达水平;不同处理后RAW264.7细胞内线粒体膜电位变化的(B)CLSM图像和(C-D)流式细胞术定量结果;(E)CLSM观察不同材料处理后细胞内活性氧的荧光强度。在图A和B中,Ⅰ是PBS;Ⅱ是LPS;Ⅲ是CAT;Ⅳ是G2-OH24/BSA;Ⅴ是Que;Ⅵ是G2-OH24/CAT;Ⅶ是G2-OH24/CAT@Que。
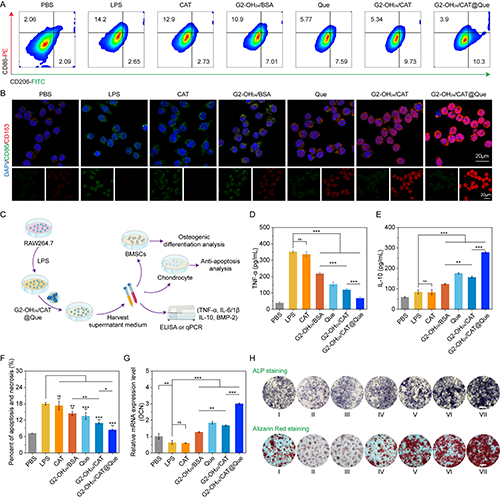
图5.(A)不同材料处理后巨噬细胞极化的流式细胞图;(B)不同材料处理后细胞中CD86和CD163表达的免疫荧光染色结果图;(C)条件培养基的提取和培养示意图;(D-E)检测不同材料处理后细胞上清液中的TNF-α和IL-10的表达水平。(F)不同条件培养基处理后软骨细胞的凋亡和坏死情况;(G)不同条件培养基处理后BMSCs中OCN mRNA的表达水平;(H)不同条件培养基处理后BMSCs的ALP和茜素红染色结果。在图H中,Ⅰ是PBS;Ⅱ是LPS;Ⅲ是CAT;Ⅳ是G2-OH24/BSA;Ⅴ是Que;Ⅵ是G2-OH24/CAT;Ⅶ是G2-OH24/CAT@Que。
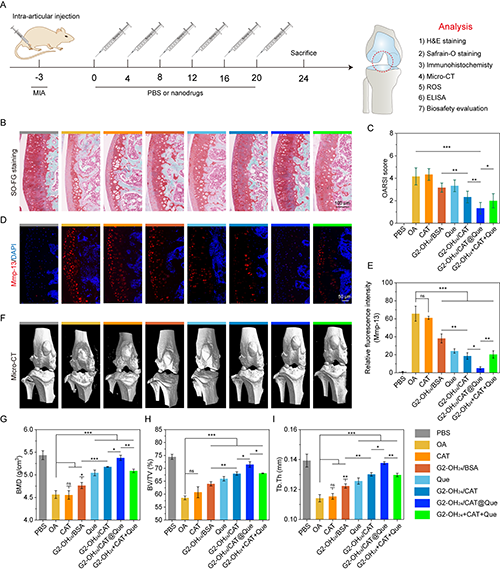
图6.(A)OA小鼠模型的体内治疗方案;(B-C)不同治疗后小鼠炎症膝关节的番红-O-固绿染色和OARSI评分结果。(D-E)不同治疗后小鼠炎症膝关节的Mmp-13免疫荧光切片染色和相对荧光强度;(F-I)不同治疗后小鼠炎症膝关节的Micro-CT成像图以及BMD、BV/TV、Tb.Th定量结果。
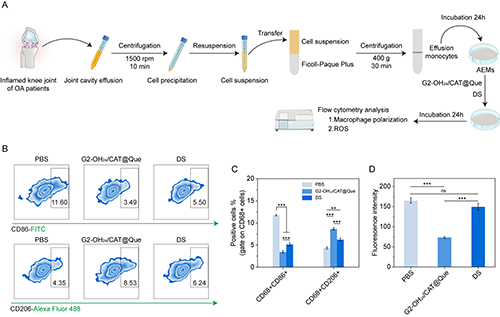
图7.(A)AEMs的提取分离示意图;(B-C)不同材料处理后AEMs中巨噬细胞极化的流式细胞结果;(D)不同材料处理后AEMs中活性氧水平的流式细胞术定量结果。
简而言之,该研究设计的基于羟基化含磷树状大分子的蛋白质/药物共递送平台具有多个优势:1)提高CAT和Que的生物利用度,实现功能药物的细胞内共递送;2)通过缓解缺氧和恢复线粒体稳态,实现巨噬细胞向M2抗炎表型极化和抗氧化的重编程;3)利用巨噬细胞重编程产生的免疫效应来重塑骨免疫微环境,促进BMSCs成骨分化并抑制软骨细胞凋亡,实现OA的综合治疗。本研究提出了一种基于含磷树状大分子纳米药物的共递送系统,通过发挥树状大分子、药物和蛋白质的全活性成分的优势,可有效治疗OA或其他炎症性疾病。
文章链接:https://doi.org/10.1016/j.biomaterials.2024.122999
- 天津大学刘文广/崔春燕团队、天津医院杨强团队 AFM:珊瑚启发的原位成孔的生物活性黏合剂用于兔桡骨骨折修复 2025-06-04
- 华科大杨光教授团队《Bioact. Mater.》综述:含有生物活性分子和干细胞的载体型水凝胶用于缺血性脑卒中治疗 2025-03-09
- 上海交大赵慧教授、朱申敏教授团队《ACS Nano》:仿生手性螺旋结构触发的“生物活性”治疗性接触镜用于角膜损伤快速修复 2025-03-01
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 东华大学史向阳教授团队 Nano Today:基于含磷树状大分子的药物递送系统协同增强自噬、抗炎和抗氧化治疗阿尔茨海默症 2025-02-11
- 华东理工刘润辉教授课题组《Nat. Biotechnol.》:基于宿主防御肽模拟物组装体的共递送组合体内协同治疗耐药真菌感染 2026-01-02
