华东理工刘润辉教授课题组 Nat. Microbiol.:细胞膜和DNA双靶点抗耐药真菌
耐药真菌严重威胁人类生命健康,传统的单靶点抗真菌药物难以应对耐药真菌的迅速发展。双靶点药物有望通过作用于微生物的多个途径显著降低真菌耐药发生,在药物研究中具有很大前景。因此,设计和发现双靶点抗耐药真菌新分子对耐药真菌感染治疗和应对真菌耐药性挑战具有重要意义。然而,发现具有高活性、高选择性的双靶点抗耐药真菌活性分子是本领域重大挑战,一直未取得突破。
近期,刘润辉教授课题组首次设计并发现了具有高活性和高选择性的双靶点高效抗耐药真菌新分子,解析了新分子通过真菌细胞膜和DNA双靶点抗耐药真菌新机制,提出了双靶点抗耐药真菌活性分子的设计策略,为抗耐药真菌药物新机制研究和应对抗真菌耐药性挑战提供了新思路。该成果以“A dual-targeting antifungal is effective against multi-drug resistant human fungal pathogens”发表在Nature Microbiology (Nat. Microbiol, 2024, DOI: 10.1038/s41564-024-01662-5)。
临床抗真菌药物数量有限且往往伴随着严重的毒副作用,导致真菌感染对人类健康构成重大威胁,真菌耐药性的迅速出现和传播加剧了这一现状。双靶点药物可同时作用于微生物的多个途径,可有效减缓耐药性的产生,在药物研究中具有很大前景。尽管临床中通过两种药物联用的替代方案实现双靶点抗耐药真菌,但两种药物在体内的分布和药代动力学各不相同,使得治疗效果受到限制。真菌和哺乳动物细胞同作为真核细胞结构高度相似,导致抗真菌靶点有限,即使发现单一靶点的选择性抗真菌分子也极其困难。因此,双靶点药物在抗真菌研究领域一直未取得突破。
刘润辉教授课题组在前期研究中,提出了以优异生物安全性的聚噁唑啉(多肽主链上酰胺键转移至侧链)模拟天然多肽,创新性地实现了基于聚噁唑啉骨架的功能性多肽模拟,发现了体内外高效抗耐药细菌和耐药真菌的聚噁唑啉活性分子(Angew. Chem. Int. Ed. 2020, 59, 6412,VIP论文,ESI高被引;Angew. Chem. Int. Ed. 2022, 61, e202200778,VIP论文;J. Am. Chem. Soc. 2023, 145, 25753,JACS Spotlight)。本研究中进一步提出通过正电荷和两亲性的聚噁唑啉模拟宿主防御肽同时引入DNA结合基团作为疏水性结构的设计策略,通过调控正电荷和DNA结合基团的比例成功获得了高活性、高选择性双靶点抗耐药真菌新分子。双靶点活性分子对多种临床常见耐药真菌(包括念珠菌属、新生隐球菌、格特隐球菌和烟曲霉菌)具有高活性和高选择性,在角膜炎、擦伤、系统感染等多个小鼠感染模型中展示优异治疗耐药真菌感染效果,为抗耐药真菌药物设计和新机制研究提供了新思路(图1)。
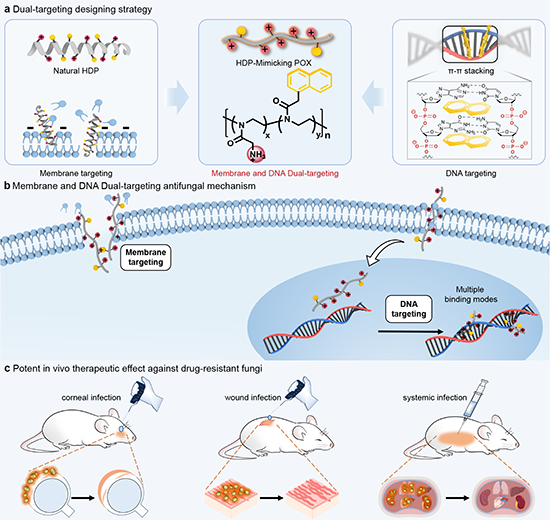
图 1 真菌细胞膜和DNA双靶点的HDP模拟聚噁唑啉的设计策略与抗耐药真菌感染性能
本研究首先设计可与DNA通过π-π作用结合的萘基作为聚噁唑啉的疏水基团,侧链氨基为正电荷基团,通过2-噁唑啉单体共聚合成了不同正电荷和DNA结合基团比例的HDP模拟聚噁唑啉分子库,并探究了一系列聚噁唑啉的抗耐药真菌活性和哺乳动物细胞以及血红细胞毒性。其中,DNA结合基团比例20%的聚噁唑啉 (Gly0.8Nap0.2)20的抗耐药真菌活性(MIC=0.78–3.13 μg/mL)与抗耐药真菌药物两性霉素B相当(MIC=0.78–1.56 μg/mL),对血红细胞和成纤维细胞的选择性(HC50/MIC=1–2, IC50/MIC=1–2)远超过两性霉素B(HC50/MIC=1–2, IC50/MIC=1–2),表明优选聚噁唑啉 (Gly0.8Nap0.2)20具有出优异的抗耐药真菌活性与抗真菌选择性(图2)。

图 2 HDP模拟聚噁唑啉的合成、表征与体外抗耐药真菌活性
优选HDP模拟聚噁唑啉 (Gly0.8Nap0.2)20优异的抗耐药真菌性能促使他们研究其抗真菌机制。通过共聚焦显微镜研究观察荧光标记的聚噁唑啉的动态杀菌过程,发现(Gly0.8Nap0.2)20在加入真菌溶液后立即积聚在真菌表面并逐渐进入真菌细胞质。孵育 60 秒后, 在真菌细胞质中观察到大量的(Gly0.8Nap0.2)20,但没有 PI 信号。72 秒后,在真菌细胞质中观察到红色荧光 PI 信号,表明真菌被杀死。值得注意的是,(Gly0.8Nap0.2)20与真菌共孵育后,真菌的 ζ 电位从?5.3 mV 变为+11.9 mV。进一步研究发现 (Gly0.8Nap0.2)20显示出可忽略的真菌细胞壁扰动和明显的真菌质膜去极化。此外,添加带有负电荷的外源真菌膜脂质成分磷脂酰肌醇和磷脂酰甘油后 (Gly0.8Nap0.2)20的抗真菌活性被显著抑制,通过扫描电子显微镜(SEM)观察到 (Gly0.8Nap0.2)20处理后的白色念珠菌 K1细胞膜出现明显受损。以上研究表明了细胞膜作为 (Gly0.8Nap0.2)20的一个抗真菌作用靶点(图3)。

图 3 双靶点聚噁唑啉 (Gly0.8Nap0.2)20的真菌膜作用靶点研究
进一步通过共聚焦显微镜观察在DNA结合染料DPAI (结合后为蓝色荧光)存在下 (Gly0.8Nap0.2)20对白色念珠菌 K1 的杀菌过程,他们发现 (Gly0.8Nap0.2)20在真菌细胞质中不断富集随后逐渐进入真菌细胞核,在进入整个真菌细胞核超过 30 秒后,真菌细胞质中突然出现红色荧光 PI 信号,表明真菌被杀死。随后,真菌DNA-DAPI 结合产生的蓝色荧光逐渐消退,意味着与DNA结合的DPAI可能被 (Gly0.8Nap0.2)20取代。他们从真菌中提取出DNA 并将其与 (Gly0.8Nap0.2)20的共孵育,发现DNA粒径从 47nm 增大 154nm;进一步研究 (Gly0.8Nap0.2)20对 不同的DNA 结合染料的竞争性置换实验,结果发现 (Gly0.8Nap0.2)20对DAPI(一种代表性的 DNA 小凹槽结合染料)和EB(一种代表性的DNA嵌入染料)都显示显著的荧光猝灭效果。同时,在真菌 DNA 中加入 (Gly0.8Nap0.2)20后的紫外、圆二色谱和ζ 电位测试结果也表明 (Gly0.8Nap0.2)20对DNA的结合。在抗菌测试中添加外源的DNA,(Gly0.8Nap0.2)20的抗真菌活性被显著抑制。这些结果共同表明了(Gly0.8Nap0.2)20通过作用于真菌细胞膜和DNA双靶点杀菌机制(图4)。
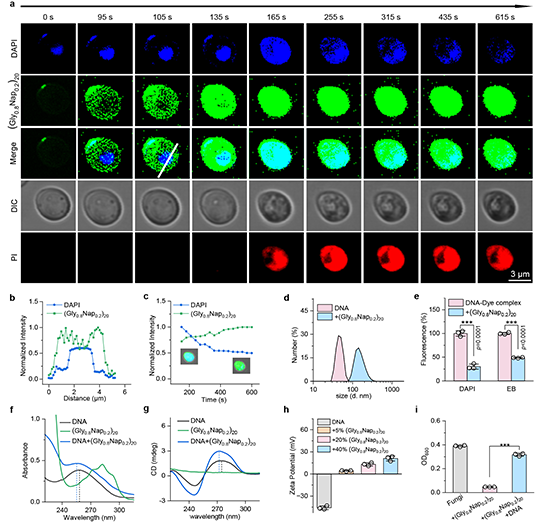
图 4 双靶点聚噁唑啉 (Gly0.8Nap0.2)20的真菌DNA作用靶点研究
在小鼠角膜炎和皮肤擦伤感染模型感染中,双靶点聚噁唑啉 (Gly0.8Nap0.2)20均显示了与临床抗真菌药物相当的耐药真菌感染治疗效果,(Gly0.8Nap0.2)20显著降低了感染部位的菌落负荷,减少了菌丝入侵的严重程度,并且未发现明显毒性,展示了突出的耐药真菌局部感染治疗潜力(图5)。

图 5 双靶点聚噁唑啉 (Gly0.8Nap0.2)20有效治疗耐药真菌角膜炎和皮肤擦伤感染
在白色念珠菌诱导的小鼠系统感染模型中,双靶点聚噁唑啉 (Gly0.8Nap0.2)20有效救治感染小鼠,并提高感染小鼠的存活率,存活率与临床抗真菌药物两性霉素B相当。并且 (Gly0.8Nap0.2)20能够清除小鼠多个器官中的真菌,降低真菌负荷,阻止真菌对心、肾等器官的入侵。此外,处理后小鼠的组织学分析和血液生化指标结果显示 (Gly0.8Nap0.2)20具有优异的体内生物相容性和安全性,表明(Gly0.8Nap0.2)20具有优异的耐药真菌系统感染治疗潜力(图6)。

图 6 双靶点聚噁唑啉 (Gly0.8Nap0.2)20有效治疗耐药真菌系统感染
华东理工大学材料科学与工程学院副研究员周敏、博士研究生刘龙强是论文的第一作者,刘润辉教授为通讯作者。该成果得到了国家自然科学基金委杰出青年科学基金、科技部重点研发项目等基金的资助。
论文链接: https://www.nature.com/articles/s41564-024-01662-5






