细菌无处不在,人类与细菌相宿相生。抗生素可以迅速杀灭致病菌,保障人类的生命安全。但抗生素的大量和不合理使用,导致多重耐药细菌即“超级细菌”出现,严重威胁着人类和动物健康。更为严重的是,临床病原菌分离鉴定存在效率低、准确率差等缺陷,大大降低了临床治疗的时效性和有效性,导致临床上病原菌呈现持续感染、反复发作等特征。因此,高效、快速精准靶向区分病原菌对抗菌药物筛选和临床诊断治疗具有重要意义。
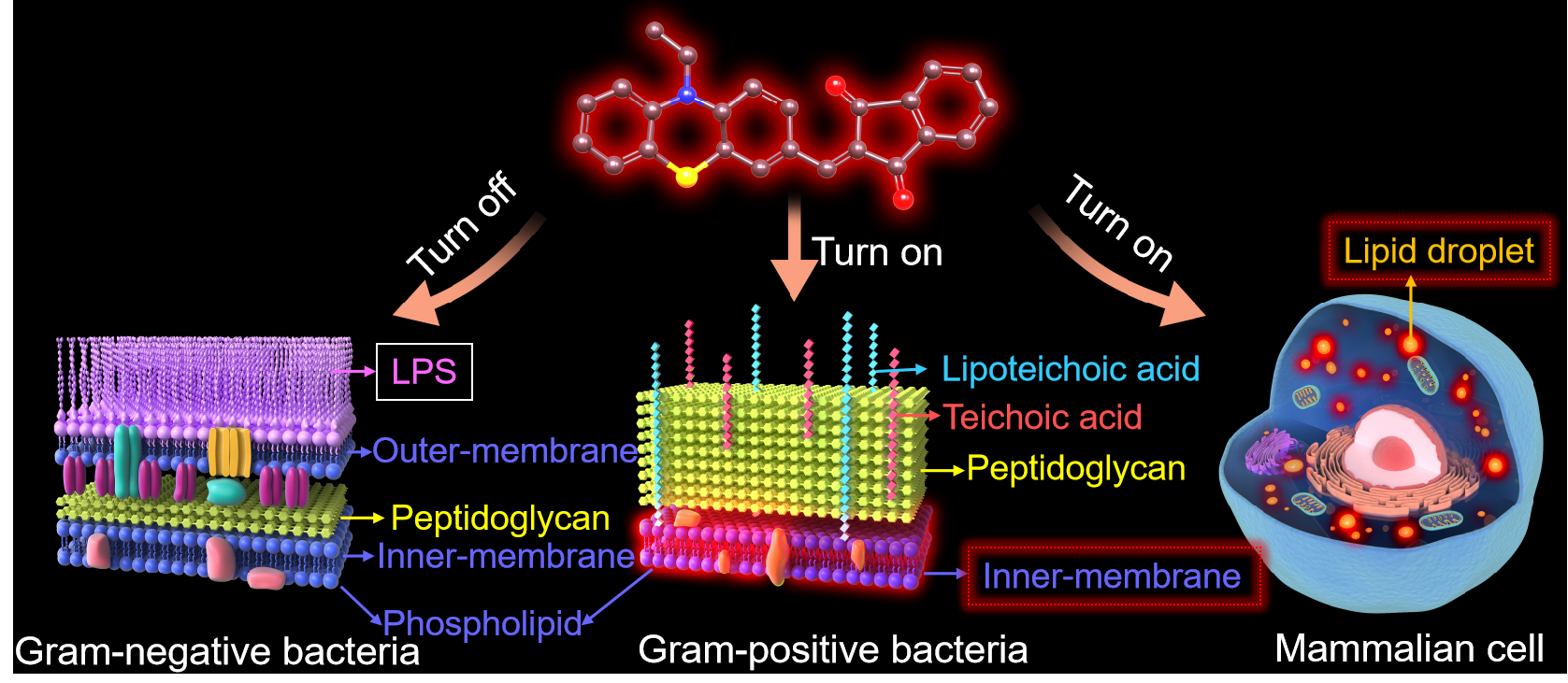
图1. PH-ID对革兰氏阳性菌特异性成像机制示意图。
细菌主要分为革兰氏阳性菌(G+)和革兰氏阴性菌(G-)两大类,为实现快速筛选革兰氏阳性菌和阴性菌,提高临床药物治疗有效性,广东工业大学冯星副教授与广州医科大学李莹教授、香港中文大学(深圳)唐本忠院士团队开发了一种电荷中性、特异性脂滴成像的红光聚集诱导发光材料(PH-ID),能够在10分钟内实现G+的特异性染色和成像,成功染色的G+发出红色的荧光且肉眼可见,而PH-ID未对G-染色(图1)。本研究不但提供了一种新型的红光AIE材料,可实现对阴性/阳性细菌的高效区分与准确筛选,为临床细菌监控提供新策略,而且通过深入阐明PH-ID对G+选择性成像机制,为AIEgens合理设计和高效利用提供理论依据,为新型抗菌药物创制提供技术手段和骨架结构。该工作以“Lipid Droplet-Specific Red Aggregation-Induced Emission Luminogens: Fast Light-Up of Gram-Positive Pathogens for Identification of Bacteria”为题发表在《ACS Materials Letters》上(ACS Materials Lett. 2022, 4, 1523?1530)。文章第一作者是广东工业大学硕士研究生王晓慧和中国农业大学博士后宋玫蓉。该研究得到深圳大学王东教授和中国农业大学朱奎教授的帮助,以及国家自然科学基金委、广东省自然科学基金委、广东工业大学“青年百人计划”的支持。

图2.PH-ID对(A)革兰氏阳性菌和(B)革兰氏阴性菌染色成像图。
研究团队测试了AIE分子PH-ID对革兰氏阳性菌(表皮葡萄球菌(S. epidermidis)、金黄色葡萄球菌(S. aureus), 耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌 (VRE))和革兰氏阴性菌(大肠杆菌 (E. coli), 耐氨苄西林大肠杆菌(E. coli ToP10), 多药耐药大肠杆菌(MDR E. coli), 多药耐药肺炎克雷伯菌(MDR K. pneumoniae)染色和成像,发现10 min 内PH-ID染色革兰氏阳性菌,而提高浓度和染色时间均未对革兰氏阴性菌染色(图2)。

图3.(A)PH-ID与细菌膜商业染料共染荧光图。(B)微量热泳动(MST)测定PH-ID与细菌质膜膜磷脂成分的亲和力。
膜靶向是AIE材料抗菌治疗和细胞成像的重要机制,但AIE材料对细菌的特异性靶向机制尚不清晰。进一步探究PH-ID分子与细菌结合的潜在靶标,利用MST测试PH-ID与细菌质膜的磷脂酰甘油(PG),磷脂酰乙醇胺(PE),心磷脂(CL)和哺乳动物细胞膜的磷脂磷脂酰胆碱(PC)的亲和力。PH-ID对PG、PE、CL、PC均表现出高亲和力,平衡解离常数(KD)分别为25.8、25.0、16.6和16.1 μmol/L(图3B)。结果表明电中性的PH-ID主要通过疏水作用结合质膜磷脂分子。对于革兰阴性菌,其疏水屏障外膜可阻碍高疏水性的化合物进入细菌。PH-ID具有高疏水性(cLogP = 5.50),推测革兰阴性菌外膜阻碍了PH-ID与质膜表面磷脂结合。通过CRISPR基因编辑及突变诱导等生物学试验,构建LPS缺陷鲍曼不动杆菌,PH-ID成功染色LPS缺失鲍曼不动杆菌,说明革兰阴性菌的LPS是PH-ID对革兰阳性菌特异性的原因。因此,AIE分子PH-ID是膜靶向抗菌候选物的潜在来源,是阐明膜靶向抗菌作用机制的有效模式分子。研究结果为膜靶向AIEgens合理设计和高效利用提供理论依据。
原文链接:https://pubs.acs.org/doi/10.1021/acsmaterialslett.2c00551



