血管新生在生长发育,肿瘤,动脉粥样硬化,工程化的类器官和工程组织等过程中起着重要作用,但是其力学调控机理并不清楚,因此在体外构建血管模型并重现其在体微环境对探究血管生成机制至关重要。
近日,北京航空航天大学生物医学工程高精尖中心樊瑜波教授团队结合微加工,生物力学数值分析和细胞生物学等多学科技术,设计并成功制备了一种在体外模拟血管生成初始阶段微环境的三维血管芯片及其控制系统。该系统具有自动、高效、高仿真、低消耗等特点,可对内皮细胞所受壁面剪切力、跨内皮流、间质流及生长因子浓度梯度等进行精准调控。依托该微流控系统,对剪切力的传导过程进行了探索,发现腔内流诱导产生的壁面剪切力对包括血管新生和动脉生成在内血管生成均有抑制作用,血管内皮细胞表面的硫酸乙酰肝素作为力传感器参与介导这一过程。研究发现只要偏离血管稳定状态,例如降低剪切应力,增加的生长因子浓度和破坏的力传导,均会引发血管新生。
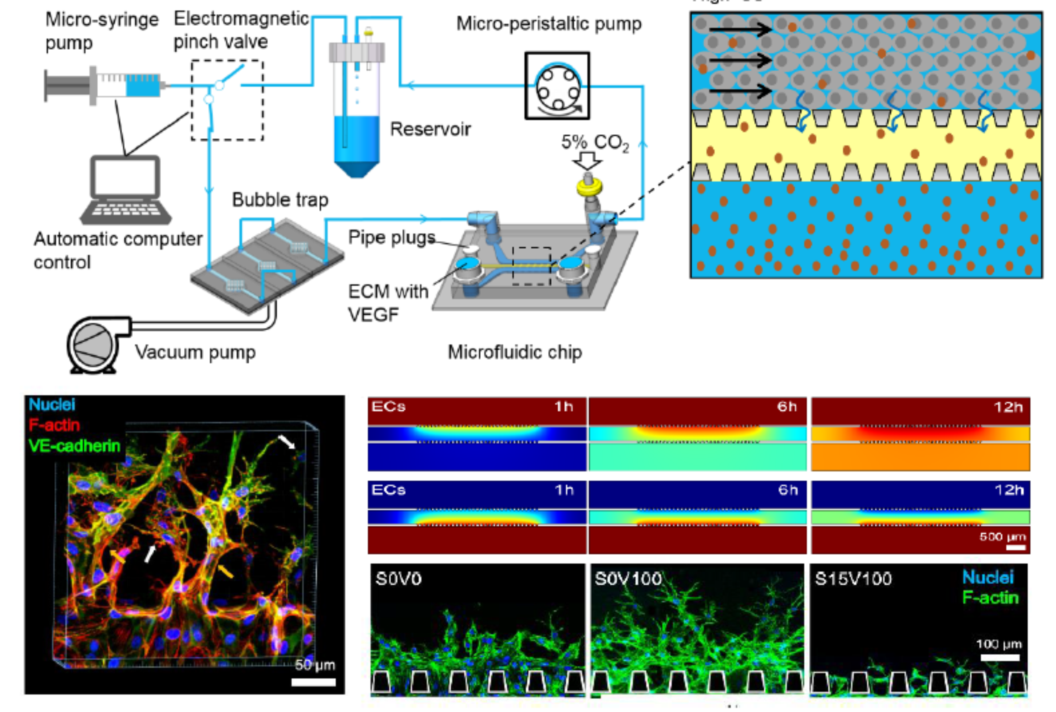
该工作突破了既往同类芯片的瓶颈,首次实现了对内皮微血管同时进行大范围精确力调控、长时间、低消耗的流动刺激,并发现了相关的力传导机理。该研究有望推动血管生成相关研究的进展,并且在药物筛选和毒理分析等领域有广泛的应用前景。
北航生物与医学工程学院博士生赵萍为该论文第一作者,樊瑜波教授、刘肖副教授和邓小燕教授为通讯作者。北京航空航天大学生物医学工程高精尖中心与生物与医学工程学院为第一单位,北京城市系统工程研究中心,清华大学附属第一医院,中国人民解放军第306医院,中国人民解放军第304医院等单位参与完成。该研究成果得到了国家自然基金重大仪器、国家自然科学基金、国家重点研发计划项目和高等学校学科创新引智计划经费等项目支持。该研究以题为“Flow shear stress controls the initiation of neovascularization via heparan sulfate proteoglycans within biomimic microfluidic model”发表在微流控领域著名期刊Lab on a chip。
全文链接:https://pubs.rsc.org/en/Content/ArticleLanding/2020/LC/D0LC00493F#!divAbstract
- 浙江大学贺永教授课题组:水凝胶三维微流控芯片及在其上构建的血管芯片 2018-10-17
- 川大微粘控团队 AFM:次序交互式纤维微流控相分离技术制备纳米皮肤纤维 2025-09-15
- 香港大学Alan C. H. Tsang教授团队 Nano Lett. 封面:智控微流 - 热场与异质结构的竞争与协同 2025-09-07
- 南林黄超伯、宁波材料所陈涛《Adv. Mater.》:生物启发的具有可调螺旋结构的异质球体 → 用于准确有效地控制血糖水平 2025-06-18
