丝蛋白是构成蜘蛛丝、蚕丝等天然纤维材料的主要物质,以其超高的强度、延展性、生物相容性以及可降解等优越性能,引起了人们的广泛关注。丝蛋白原纤维一般由两种主要结构域组成:β片纳米晶体和无定形结构(图1)。其中β片纳米晶体是一种由氢键网络连接起来的多肽链组成的高度有序结构。它们通过独特的微观结构设计,使得丝蛋白具有优异的力学性能。一般认为,β片长度在2-3nm时具有最佳剪切强度,但这无法解释自然界中丝蛋白内存在大量长度为10-20 nm左右的β片晶体。此外,Weibull统计模型预测纤维材料的强度随其长度增加而减弱。因此,一个关键的问题是,丝蛋白是如何通过这么长的β片晶体获得优异的强度的? 或者说,外部载荷对β片晶体中氢键网络的稳定性有何影响?目前这些问题还没有得到解答。

图1. 丝蛋白结构示意图。(a, b) 从宏观到纳米尺度的丝蛋白结构示意图。(c) β片的分子结构。(d) β片内由氢键网络连接起来的多肽链结构。
最近,浙江大学李德昌、季葆华课题组在Nano Letters上报道了一种异于金属的超长β片纳米晶体失效行为,提出β片纳米晶体的微观结构设计策略,可以避免由于β片纳米晶体长度增加而导致的强度减弱。
首先,课题组使用分子动力学模拟,发现了β片纳米晶体与长度有关的失效模式,其失效行为按其特征尺寸可分为三种模式,如图2所示。他们发现,长度较短的β片在剪切载荷作用下界面上氢键同时断裂,表现为一种均匀破坏的行为;中长度β片受载荷时界面上氢键依次断开,以裂纹扩展的形式断裂;而超过 ~10nm的超长β片展现了新的断裂形式,多个微裂纹在界面依次形核、移动与堆积,这些微裂纹将原本连续的氢键阵列分割成多个片段,使得长β片也可以获得高强度(图3)。微裂纹形核与堆积是由于裂纹尖端的氢键断裂和裂纹后面的氢键重组这两个过程协调完成的。这种发现于超长β片晶体中的材料强化机制类似于金属中的位错成核、发射和堆积。
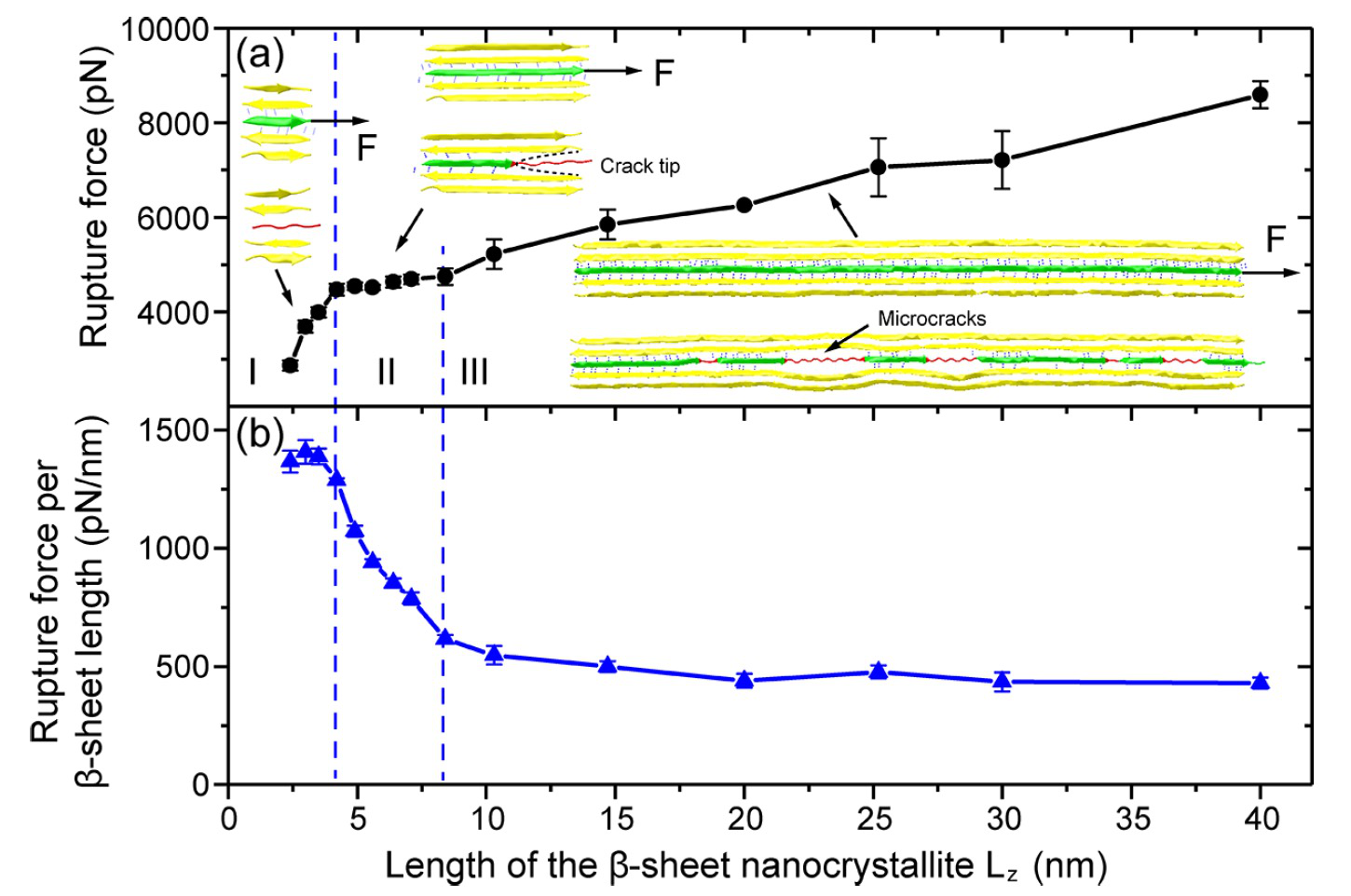
图2. β片纳米晶体的强度与长度的关系。
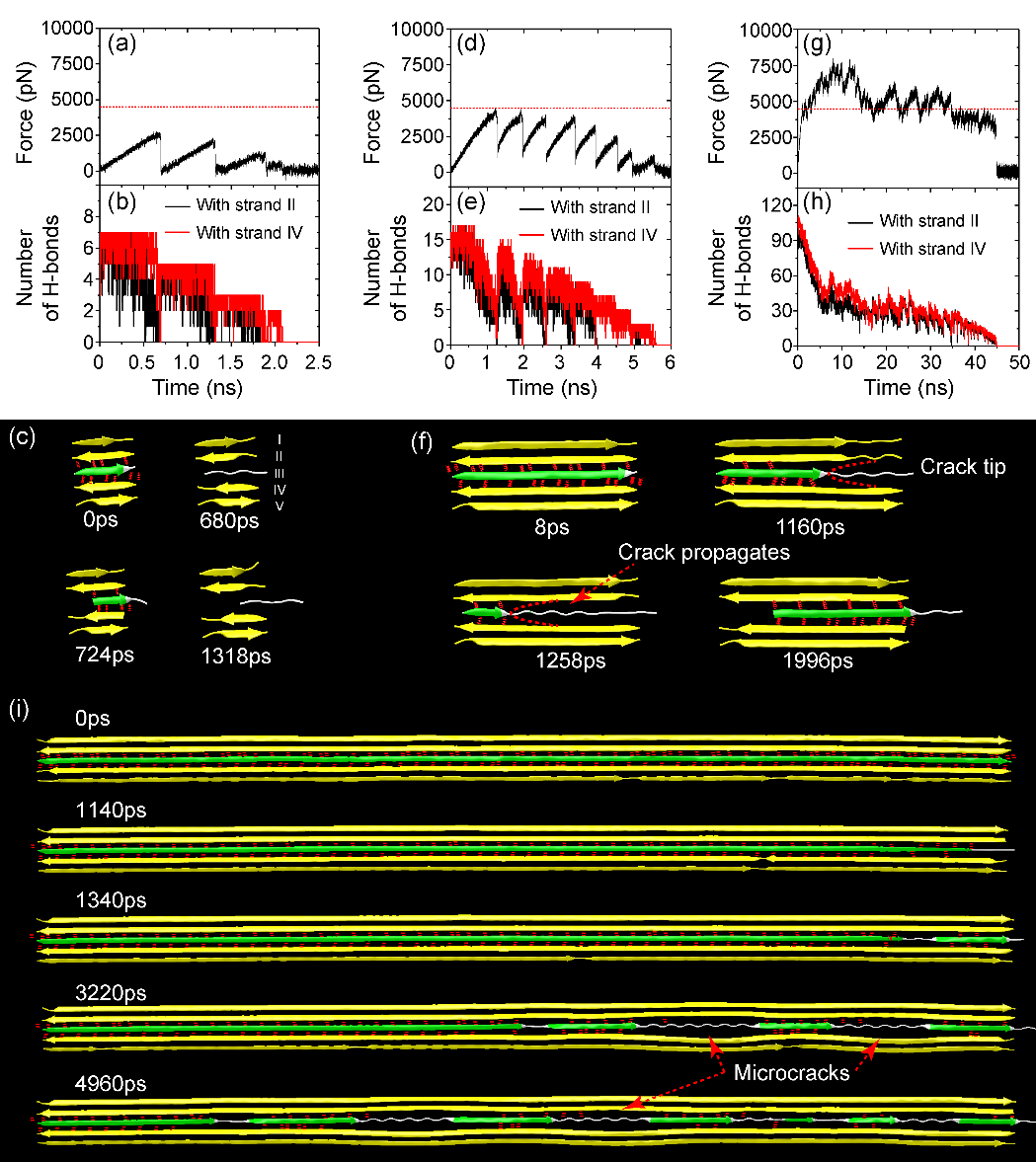
图3. 不同长度β片纳米晶体的剪切失效行为。(a, b, c) 短β片,长度为2.1 nm。(d, e, f) 中长度β片,长度为5.6 nm。(g, h, i) 超长β片,长度为42 nm。
接下来,为了理解多裂纹形核机制课题组基于β片的微观结构,建立了弹性-统计力学模型,分析了β片晶体的特征尺度和肽链刚度对β片晶体中氢键网络稳定性的影响(图4)。该模型预测了β片长度依赖的剪切失效模式和行为。当β片长度超过某个临界值时,氢键的存活概率在剪切界面的分布呈近似周期分布。该模型还预测了氢键片段和微裂纹的长度取决于肽链的拉伸刚度,氢键片段和微裂纹的长度都随着肽链刚度的降低而减小。
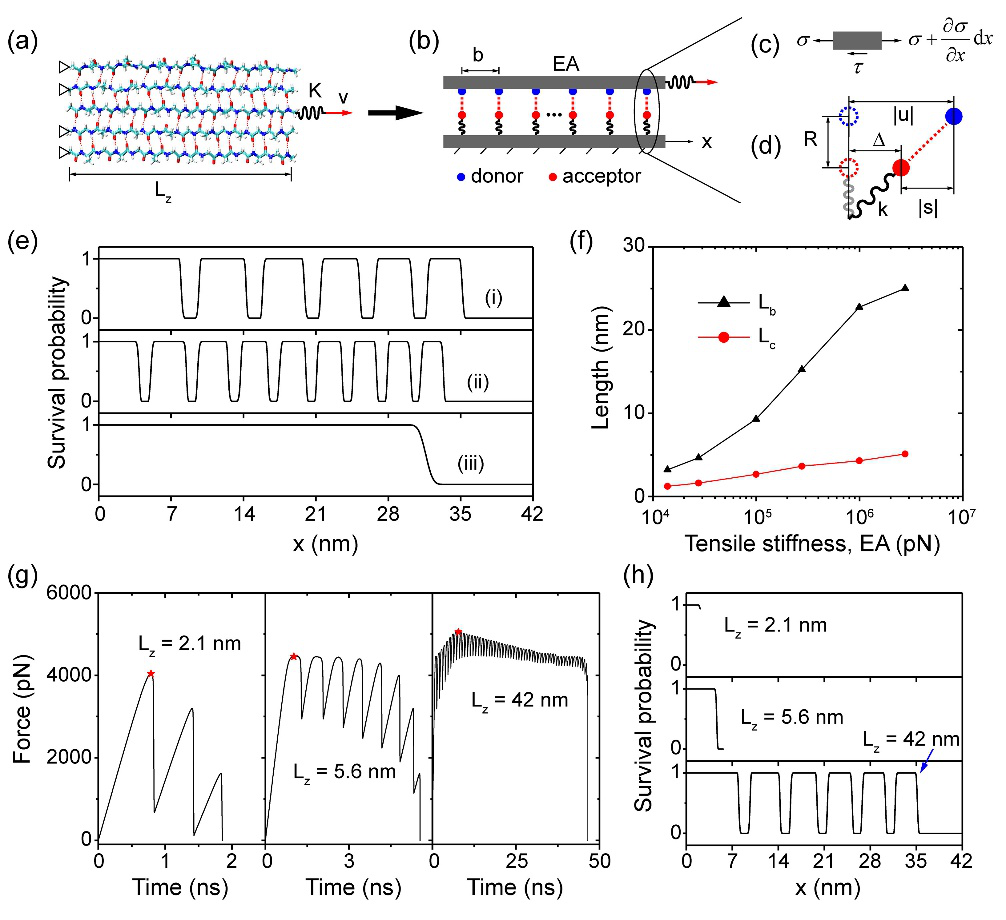
图4. (a-d) β片纳米晶体的剪切失效行为的弹性-统计力学模型。(e, f) 肽链的拉伸刚度对β片剪切失效行为的影响。 (g, h) β片长度对其剪切失效行为的影响。
这一新的机理将为构建兼具功能和结构的超强高分子材料提供理论指导。相关论文发表在Nano Letters上,浙江大学李德昌副教授为文章的第一作者,季葆华教授为通讯作者,北京理工大学博士研究生王乾春和硕士研究生徐昌建参与了该工作。该论文工作还获得了新加坡高性能计算研究所张永伟教授和程渊教授的大力支持。
李德昌、季葆华课题组一直从事生物纳米仿生材料和细胞分子力学领域的研究工作。上述生物丝蛋白强韧化新机制与丝蛋白晶体结构中氢键的断裂/重结合行为有关,课题组前期相关工作发现生物单分子键的断裂强度在超低加载速率下呈现饱和状态(断裂强度不随加载速率变化而变化),与经典的理论模型预测不同。通过分析发现,经典的理论模型没有考虑分子键断裂后可能重新成键的物理机理。在加载速率比较高的情况下,单分子键在断裂后重新成键的概率比较小,断裂强度随加载速率降低而减小。但是,随着加载速率的下降,单分子键重新形成的概率逐渐增加。在超低加载速率下,断裂强度不再随加载速率变化而变化(Phys. Rev. Lett. 112, 078302)。本次研究发现β片纳米晶体的断裂强度也与加载速率有关,而且在加载速率低于临界速度后也出现与加载速率无关的行为。另外,生物丝蛋白的力学性能与其复杂的微观网络结构密切相关。李德昌、季葆华课题组与新加坡南洋理工大学陈晓东教授研究团队合作将高韧性材料蜘蛛丝改良,引入导电聚合物和碳纳米管,加强了生物丝蛋白微观网络结构的连接,使蜘蛛丝同时具有高韧性和高电导率,使其韧性值达到420 MJ/m3,电导率达到1077 S/cm,性能超过目前的导电材料(Nat. Commun. 2020, 11, 1332)。
上述研究工作丰富了人们对生物丝蛋白材料物理性能与其微观结构关系的理解,并为该材料的工程应用提供了新思路。
原文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.0c02968
相关文献:
https://journals.aps.org/prl/abstract/10.1103/PhysRevLett.112.078302
https://www.nature.com/articles/s41467-020-14988-5
- 苏大李刚、余嘉/牛津大学陈凯丽 Biomacromolecules: 牛角瓜纤维/蚕丝蛋白复合多功能水凝胶敷料 2025-08-19
- 塔夫茨大学David Kaplan 院士/Chunmei Li 教授团队 Nat. Commun.:基于蚕丝蛋白的生物活性塑料 2025-01-05
- 上科大凌盛杰教授课题组 Adv. Mater.:强韧、可回收、可降解丝蛋白离子导体助力柔性智能触摸屏应用 2024-12-12
- 苏州大学汪晓巧教授《Nat. Commun.》:仿生蛛丝再突破!湿纺技术制备高性能水凝胶纤维 - 兼具高强韧性与智能响应性 2025-12-03
- 南开大学刘遵峰课题组 Macromolecules:滑环交联与共价交联的协同效应指导高强韧人造蛛丝的制备 2025-10-14
- 南开刘遵峰教授课题组招收2026年入学推免硕士、直博生等 - 材料学、化学、高分子、生物学、纺织与纤维、计算模拟、电子信息... 2025-06-13
