最近,香港科技大学唐本忠院士团队与山东大学于晓强教授团队在Chemistry of Materials上发表了题为“Specific Two-Photon Imaging of Live Cellular and Deep-Tissue Lipid Droplets by Lipophilic AIEgens at Ultralow Concentration”的研究论文(Chem. Mater., 2018, 30, 4778),报道了一类脂溶性AIE材料在超低浓度下对活细胞和深层组织中脂滴的特异性双光子成像。
脂滴,是一种广泛存在于大多数细胞和生物体系中的动态细胞器,参与了许多重要的生理功能,包括脂质代谢、膜合成和转移、信号转导、蛋白质降解等。近年来研究发现,脂滴与肥胖、糖尿病、炎症和癌症等紧密相关。因此,开发出有效的方法对活细胞和活组织样本中脂滴的直接和选择性可视化和监测显得格外重要。

Scheme 1. 商用和文献报道的脂滴荧光探针结构
(来源:Chem. Mater.)
Nile Red和BODIPY 493/503是常用的脂滴染色商用荧光染料(Scheme 1),不过它们存在着非特异性染色、Stokes位移小和光稳定性差等缺点。近年来,为了解决这些问题,国内外研究组做了很大努力,开发了多种新型脂滴荧光探针(Scheme 1)。通常用于脂滴染色的探针浓度在5-10 μM或更高的范围内,但这些染料由于存在聚集荧光猝灭(ACQ)效应而显示弱的荧光。只有少数染料能在纳摩尔浓度下对脂滴成像,然而这些染料在活细胞内显示非特异性染色和蓝色荧光,从而导致低的信噪比。另一方面,这些基于ACQ的染料具有小的Stokes位移和低的光稳定性,并且其在双光子深层组织荧光成像中的应用也很少被探索。这些局限性促使研究人员寻找具有更好性能(比如双光子深层组织成像、低孵育浓度、大Stokes位移、高光稳定性和优异的生物兼容性)的新型荧光探针。
Scheme 2. 唐本忠院士团队开发的用于脂滴荧光成像的AIEgens
(来源:Chem. Mater.)
2001年,香港科技大学唐本忠院士提出了与ACQ效应完全相反的聚集诱导发光(AIE)现象,其具有重要的学术价值和实际意义。基于此,团队开发了一系列多色发射、高光稳定性和优异生物兼容性的AIE荧光材料(AIEgens,Scheme 2),用于选择性脂滴荧光成像,并且实现了细胞和固定组织中脂滴的双光子荧光成像。考虑到活体样品中高浓度染料的成像可能会影响细胞的正常生理活动,因此,开发出能够在低浓度下发挥作用的新型双光子AIEgens是很有必要的。此外,很少有人关注上述ACQ染料和AIEgens的固有特征与活细胞中脂滴染色特性之间的关系。
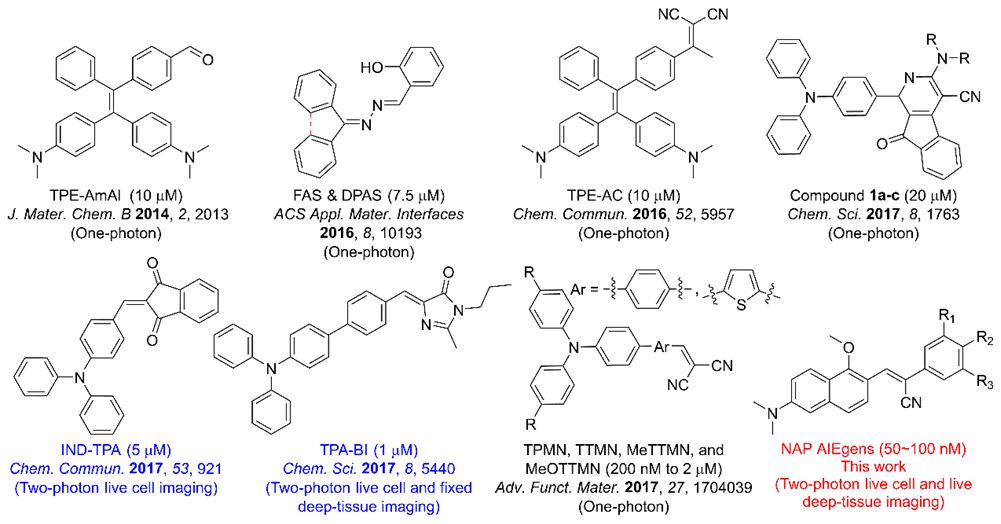
由于高含量甘油三酯和胆固醇酯的存在,脂滴内的固有环境是亲脂性的,故具有高疏水性的亲脂性有机染料可能显示出潜在的靶向脂滴染色能力。具有给体-受体结构的有机染料已被研究了很长一段时间,通过引入大的杂环以增加受体的吸电子能力,所得有机染料通常发生红移,并具有更高的疏水性和更大的双光子吸收截面,但是细胞穿透性也变得更低。因此,有机荧光材料的疏水性和细胞渗透性之间的平衡应该仔细权衡和调整。另一方面,基于萘的给体-受体分子已经被证明是双光子荧光探针,并用于活细胞中荧光检测和生物成像。然而,萘却很少被用作构建AIEgens的核。通过引入不同的受体结构单元,作者合成了一系列基于萘的给体-受体新型双光子AIEgens体系(NAP AIEgens,Figure 1), 并在超低浓度下实现对活细胞和深层组织中脂滴的特异性双光子荧光成像。
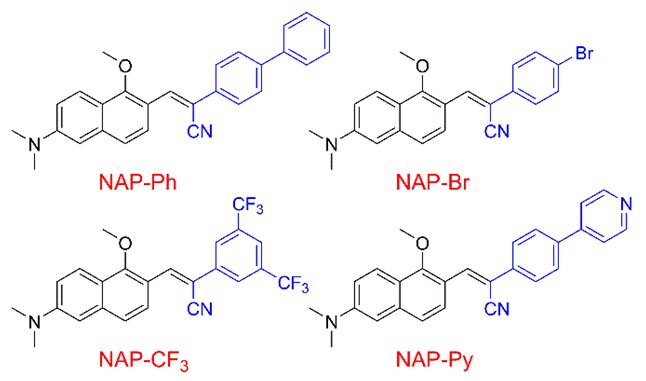
Figure 1. NAP AIEgens的分子结构
(来源:Chem. Mater.)
作者首先详细地研究了这类基于萘的给体-受体荧光材料的光物理性质(Table 1)。研究发现,由于分子内运动,它们在THF溶液中显示非常弱的荧光(荧光量子产率:1.4-1.8%);在含水量高的THF中,材料的荧光显著增强,动态光散射结果证明这类荧光材料在溶液中形成了聚集体。重要的是,这些荧光材料由于分子内运动受限(RIM),在固态显示出非常亮的黄绿光至红光的发射(荧光量子产率:12.6-29.2%),证明此类材料是AIE荧光材料。相对于溶液中短的荧光寿命,固体中长的荧光寿命进一步证实了RIM是NAP AIEgens固体荧光增强的原因。NAP AIEgens也具有大的Stokes位移、正的溶致变色效应和好的双光子吸收截面(在860 nm处为45-100 GM)。
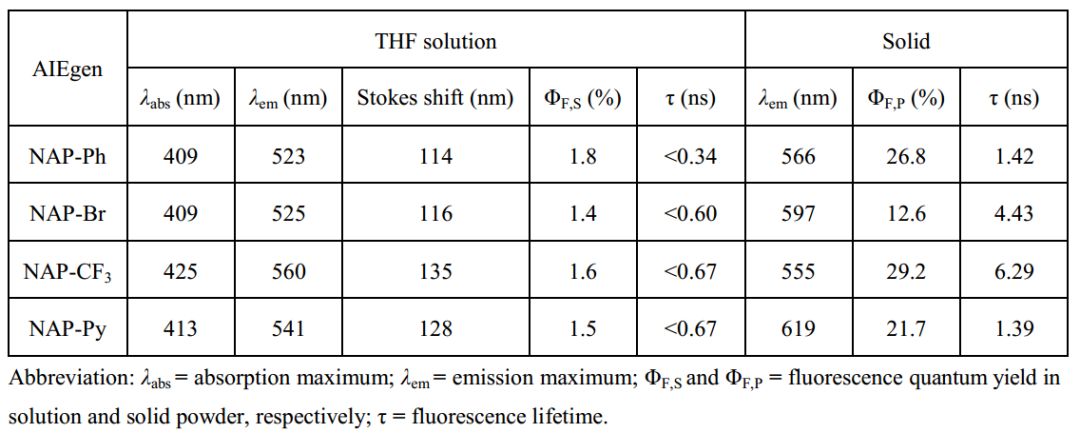
Table 1. NAP AIEgens的光物理性质
(来源:Chem. Mater.)
作者接下来探索了这些NAP AIEgens在活细胞中的成像效果。原位光谱显示它们在细胞内的荧光均发生了蓝移,这主要是分子内电荷转移和细胞内非极性环境导致的。细胞共染实验揭示了NAP AIEgens和商用脂滴染料Nile Red在HeLa细胞中具有相似的染色分布(Figure 2),相应的Pearson系数分别是0.90、0.83、0.85和0.88,从而证实了这4个NAP AIEgens是新型的脂滴探针。
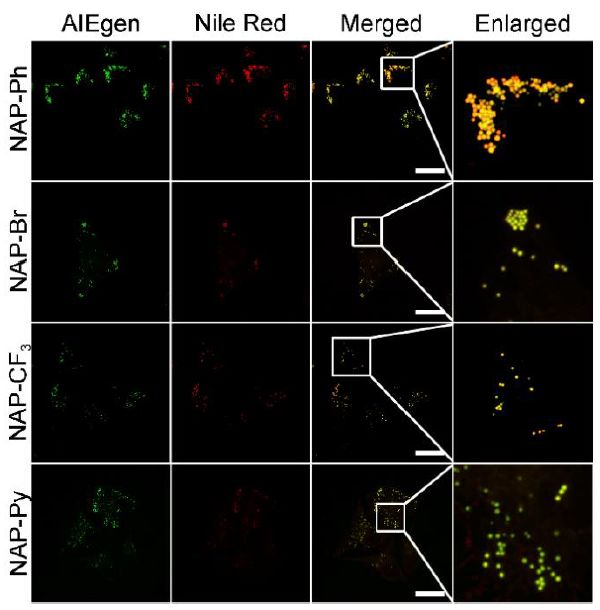
Figure 2. NAP AIEgens和Nile Red的细胞共染实验结果
(来源:Chem. Mater.)
为了合理解释NAP AIEgens对脂滴的高度特异性,作者进行了一些初步的计算。考虑到脂滴内固有的亲脂性环境,作者推测具有高疏水性或高logP(油水分配系数)值的脂溶性有机染料很可能特异性靶向脂滴,这也符合相似相溶的原理。作者通过ChemBioDraw 14.0得到了所有脂滴探针的计算的logP(即ClogP)值,发现ClogP值分布在3.1-16.643之间。Horobin等人之前基于QSAR模型报道了靶向脂滴的有机染料的logP值一般大于5。另人满意的是,NAP-Ph、NAP-Br、NAP-CF3和NAP-Py具有比Nile Red(4.618)和BODIPY 493/503(5.028)大的ClogP值(5.184-6.681,Figure 3),这可能解释了为什么这些NAP AIEgens比Nile Red显示出更好的脂滴染色效果。这些半理论性数据进一步表明了这些亲脂性AIEgens可以特异性地定位在脂滴中。
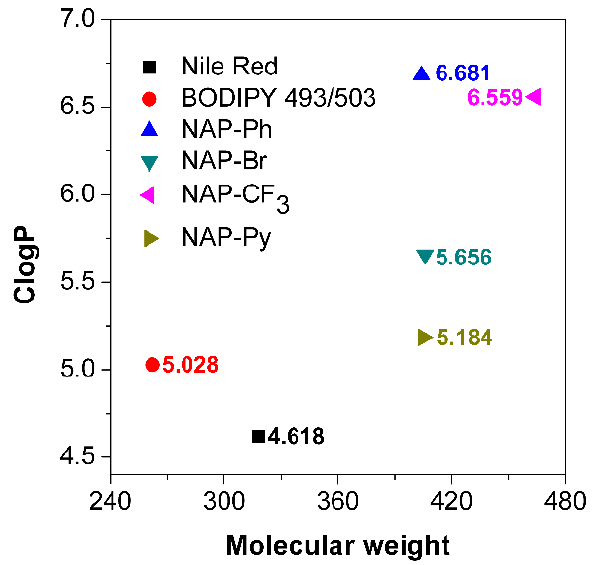
Figure 3. Nile Red、BODIPY 493/503和NAP AIEgens的ClogP值
(来源:Chem. Mater.)
作者进一步对孵育了50 nM NAP-Ph、NAP-Br、NAP-CF3和NAP-Py的HeLa细胞进行荧光成像,同时也对Nile Red在相同浓度下的染色效果做了对比。令人惊讶的是,在如此低的浓度和共聚焦激光强度(405 nm,强度=12%)下,NAP AIEgens也在脂滴中获得了强荧光,并且背景荧光很低(Figure 4)。到目前为止,这是对脂滴染色成像的最低浓度。尽管Nile Red也可在此低浓度下脂滴成像,但它在细胞质中显示出非特异性的染色,导致低的信噪比。显然,NAP AIEgens比Nile Red显示出更优异的脂滴染色效果。
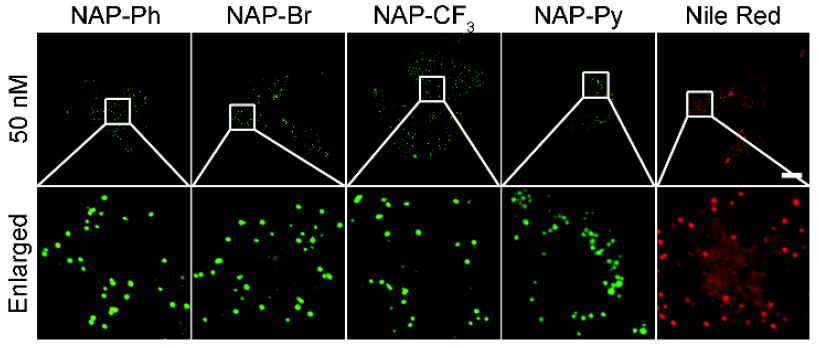
Figure 4. NAP AIEgens和Nile Red与HeLa细胞的激光共聚焦扫描成像
(来源:Chem. Mater.)
NAP AIEgens对活细胞中脂滴的特异性单光子荧光成像,促使了它们在双光子激发模式下的成像应用。如Figure 5A中所示,活的HeLa细胞中脂滴的亮绿色荧光在双光子860 nm的激发下成功被观察到,这几乎与单光子405 nm激发观察到的分布情况相同,显示了NAP AIEgens在双光子荧光成像中的巨大潜质。由于近红外光激发和低激发功率,双光子荧光成像相对于单光子荧光成像表现出深的组织穿透深度和低的背景荧光。为了进一步证实这些优点,作者对NAP-CF3孵育的活的小鼠肝组织进行了离体双光子荧光成像。1 μM的NAP-CF3孵育1 h后,明亮的双光子荧光球形斑点被成功观测到(Figure 5B);而在空白对照实验组中,作者只收集到了非常弱的组织自发背景荧光。这些数据表明,NAP-CF3在活的小鼠肝组织中也显示出优异的脂滴染色特性,并具有高信噪比。

Figure 5. 活的HeLa细胞和活的小鼠肝组织中脂滴的体外和离体双光子荧光成像
(来源:Chem. Mater.)
为了进一步探索NAP-CF3能否在活的小鼠深层肝组织中显示对脂滴的特异性染色,作者沿Z轴捕获了一系列双光子荧光成像图。如Figure 5C所示,球形斑点的双光子荧光能够沿着Z轴被清晰探测,并且穿透深度达70 μm,这是首次活的深层组织中脂滴的特异性双光子荧光成像。此外,作者沿不同显示方向成功地重建了具有高分辨率的3D双光子荧光图像,结果证明NAP-CF3的双光子成像具有高穿透性和高信噪比。脂肪肝疾病的特征是脂滴中脂质储存水平增加,并且可逐渐导致慢性肝损伤、纤维化甚至肝细胞癌。Oil Red O染色可以用于该类疾病的诊断,但Oil Red O只能染色固定组织,而固定组织的处理和固定组织切片的制备比较耗时。相对于荧光成像方法来说,Oil Red O染色的灵敏度低并且穿透深度浅。考虑到NAP-CF3具有深的组织穿透深度、高灵敏度和高选择性,NAP-CF3不仅可以在深层组织中高信噪比地研究脂滴相关的变化,同时也可以提供一种简单、快速、可靠的方法来诊断与脂滴相关脂肪肝等疾病。
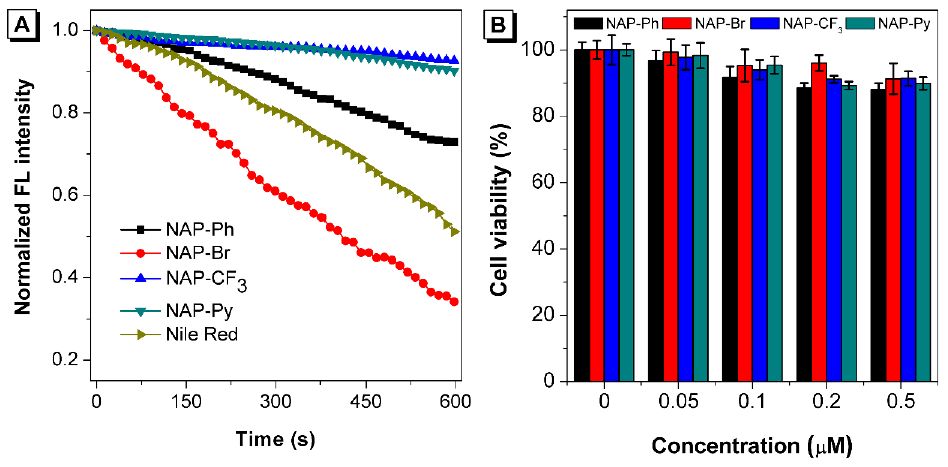
Figure 6. NAP AIEgens和 Nile Red的光稳定性以及NAP AIEgens的细胞毒性
(来源:Chem. Mater.)
为了评估NAP AIEgens的光稳定性,作者使用共聚焦激光持续照射它们染色的细胞并收集其荧光信号。持续10 min光照后,NAP-CF3和NAP-Py依然保留着高达90%的起始荧光强度,其他NAP AIEgens和Nile Red的荧光强度则有不同程度的降低(Figure 6A)。标准MTT试验评估了NAP AIEgens在活细胞中的毒性。NAP AIEgens在HeLa细胞中孵育2 h后,HeLa细胞的存活率仍然很高(>90%, Figure 6B),表明这些AIE材料在所测试的浓度内表现出可忽略的细胞毒性并且与活体样品是生物兼容的。
总结:在此工作中,作者合成了4种基于萘的新型聚集诱导发光材料并用于特异性双光子脂滴成像。它们的光物理性质通过单光子和双光子荧光光谱、密度泛函理论(DFT)计算和单晶X射线衍射进行了研究。这些新的AIE材料具有大的Stokes位移(>110 nm)、高固态荧光量子产率(高达30%)、良好的双光子吸收截面(在860 nm处为45-100 GM)、优异的光稳定性和生物兼容性等优点。这些材料可以在15 min内实现对脂滴特异性超低浓度(50 nM)成像,该浓度是目前报导的活细胞中脂滴染色的最低值。计算的油水分配系数进一步揭示了这些脂溶性聚集诱导发光材料能够特异性靶向脂滴。这类AIE材料在活细胞和活的小鼠肝脏组织中成功实现了脂滴的体外和离体双光子荧光成像;在约70 μm深的活的小鼠肝组织中也成功实现了对脂滴选择性可视化。这些优异的性能使得NAP AIEgens成为研究活体生物样品中脂滴相关生理和病理过程的优异候选荧光探针。
该论文的第一作者是香港科技大学牛广乐博士,张若瑶博士和研究生邝培竣为共同第一作者。香港科技大学唐本忠院士和山东大学于晓强教授为共同通讯作者。该研究得到国家自然科学基金委、山东省自然科学基金委、深圳市科技创新委员会等经费支持。
- 南林蔡旭敏/王石发、港中深唐本忠、浙大张鉴予 Chem. Sci.:从天然电子受体到极性/多晶型响应的BioAIE智能防伪材料 2025-12-17
- 港中大(深圳)唐本忠教授、赵征教授/港科大林荣业教授团队 Matter: 基于立体异构AIEgens在动态信息防伪与加密的应用 2025-07-28
- 南林蔡旭敏、港中深唐本忠/汪文锦团队 AFM: 松香基天然电子受体构建TICT活性的双功能BioAIE材料 2025-07-22
- 唐本忠教授/林荣业教授团队、胡连瑞研究员 Nat. Commun.:变色龙聚集诱导发光分子在光、热调控下六重稳定态的可控转换 2025-07-11
- 香港中文大学(深圳)唐本忠院士/赵征教授团队《ACS Nano》:细胞膜靶向的聚集诱导发光分子用于神经追踪和损伤的可视化 2025-01-21
- 香港中文大学(深圳)唐本忠院士与赵征教授团队《ACS Nano》综述:聚集诱导发光材料实现高分辨生物成像 2025-01-07
- 广工冯星/广医李莹/港中深唐本忠院士团队 ACS Mater.Lett.: 特异性脂滴成像红光AIE材料对阳性菌的快速成像与识别 2022-07-21
