多肽组装是一种构筑新型生物医药材料、解决多肽临床应用难题的理想手段之一。传统的多肽组装材料通常需在体外制备后再递送至病灶,这种制备-工作环境改变的模式影响材料稳定性和生物活性,同时难以确保药物精准富集,造成相应的生物安全性隐患。近年来,研究人员提出原位组装构筑多肽组装材料的策略,即利用病灶生理环境下的特定刺激源,调控多肽非共价作用、诱导其在目标部位自发组装,形成具有生物活性的纳米结构。这种方法不仅提高了医疗精准性,还增强了药物效果,为新型智能生物材料的开发提供了新的可能。尽管多肽原位组装策略在生物医学领域具有巨大潜力,但由于不同病生理条件下的组装调控策略有限,相关研究仍面临巨大挑战。

图1. 基于ncAAs调控的活细胞中多肽原位自组装机制及应用示意图。图片来源Acc. Chem. Res.。
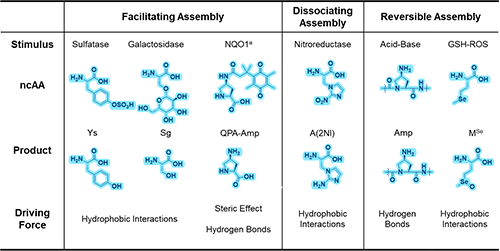
作者首先总结了自主研发的多种非典型氨基酸(表1),这些氨基酸可用于调节多肽组装的刺激响应特性。随后,作者介绍了由这些氨基酸构成的组装基元在促进多肽有序组装、解组装及可逆组装过程中的作用机制(图2)。(1)促进多肽有序组装的关键在于硫酸化酪氨酸和糖基化丝氨酸的刺激响应性切割,通过亲水基团和大体积基团的解离提高分子间有序排列,加速组装形成纳米纤维。(2)解组装过程则依赖于2-硝基咪唑丙氨酸的硝基向胺基的转化,降低多肽序列疏水性,从而促进有序组装的解离。(3)可逆组装则是通过4-氨基脯氨酸和Se-甲硫氨酸的特性实现的:前者在酸碱环境下通过脯氨酸酰胺键的顺-反构象异构化调控组装,后者依赖硒醚与硒氧化物之间的氧化还原反应调节氨基酸疏水性与亲水性转变,从而实现可逆组装。
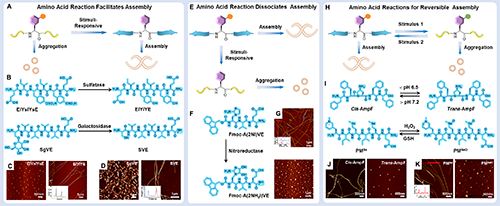
接下来作者进一步总结了基于上述刺激响应性ncAAs反应所自主研发的活细胞内组装体系。在活细胞中构建原位组装系统,需要精确调控肽的非共价相互作用。由于多肽序列与其组装行为密切相关,将刺激响应性氨基酸引入多肽骨架,能够作为优化非共价相互作用的有效策略,从而实现对组装过程的精准调控。基于此,作者利用4-氨基脯氨酸和Se-甲硫氨酸的高反应活性,建立了多种活细胞内自组装体系,包括:自分类组装(图3)、自放大组装及耗散组装体系,实现了多肽活性增强,拓展了ncAAs在活细胞环境中的原位自组装应用,还为癌症及炎症等重大疾病的精准治疗提供了全新的策略。
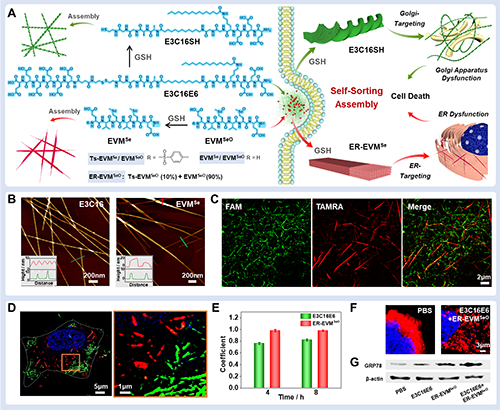
图3. 细胞内原位自分类组装。图片来源Acc. Chem. Res.。
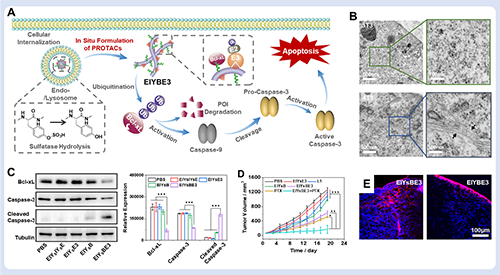
图4. 超分子PROTAC示意图。图片来源Acc. Chem. Res.。
自从回国工作以来,余志林课题组致力于发展非天然氨基酸,用于调节病生理环境下的多肽组装,并探索其在生物医药材料中的应用。这一研究不仅推动了氨基酸的创新设计,也加深了对复杂生理条件下原位组装系统的基本原理和潜在机制的理解。然而,目前对原位形成的组装体在体内的结构表征、生物降解动力学及降解途径仍缺乏深入研究,而这些问题的解决将进一步推动自组装多肽在生物医学领域的广泛应用。鉴于原位组装在实时诊断和精准治疗方面的独特优势,作者相信这类组装体在未来医疗保健领域蕴含巨大潜力,并期待其进一步发展。
论文信息:
Noncanonical Amino Acids Dictate Peptide Assembly in Living Cells
Xin Liu, Binbin Hu, Zhilin Yu*.
Accounts of Chemical Research. DOI: 10.1021/acs.accounts.4c00796.
论文链接:https://pubs.acs.org/doi/10.1021/acs.accounts.4c00796
