纳米能源所陈翔宇研究员团队 Sci. Adv.:基于位移电流的可穿戴式人体软组织断层成像技术
在活体内成像软组织对评估长期生理或病理状态,以及为患者量身定制临床管理和康复干预具有重大意义。目前,主流的非侵入成像技术(如磁共振成像MRI和计算机断层扫描CT)尽管在检测精度上具有优势,但在设备体积庞大、重量沉重、成本高昂和能耗过高等方面存在局限性。随着即时检测需求的不断增加,便携式、轻量化、可定制的可穿戴人体监测技术受到越来越多的关注。如针对心脏和乳腺的超声成像设备,以及对颅内出血敏感的磁感应断层成像技术。然而,这些设备仍面临诸多挑战,如介质耦合干预、皮肤应变引起的信号失真等问题 。更重要的是,由于组织成分和生理状态的固有差异,仅通过一种可穿戴成像设备难以实现全面的综合检测。因此,基于多样化成像机制的可穿戴成像设备的研发仍然是非常必要的。电阻抗断层成像(EIT)用于重建特定区域内电学特性的空间分布,也构成了生物医学成像的一个独特研究分支。尽管之前的研究已经验证了台式EIT仪器在人体器官监测中的可能性,但开发用于动态组织成像的可穿戴和便携式EIT设备仍面临若干基础性挑战,包括电流源内阻的频响特性、设备小型化引起的串扰以及寄生电容效应。更重要的是,为了在EIT中实现高质量成像,需要增强注入电流,但过度的电流刺激可能会对皮肤产生神经或肌肉损伤。因此,EIT的图像质量依赖于低噪声和高保真的硬件设计,其主要困难在于制备具有卓越负载适应性和信号质量的电流源。
为解决这些问题,北京纳米能源与系统研究所陈翔宇研究员团队提出了一种基于驻极体位移电流的阻抗断层成像(TIT)的可穿戴技术,可以利用用微安级别的检测电流实现人体软组织的成像检测。这得益于摩擦静电的超低电流输出和高度可控的转移电荷本质特性使得其能够催生出各种具有优异生物相容性的生物电子设备。在这种情况下,将静电能量与阻抗断层成像的成像算法相结合,可能为可穿戴断层成像系统开创一种独特的策略。本工作中设计了一种基于复合摩擦起电效应的高精度静电信号源(HESS),为该TIT系统提供具有卓越生物相容性的高质量探测电信号,同时可以使用远低于医疗设备安全标准的电流信号实现精细阻抗分析。HESS的总谐波失真达到0.03%,电流变化率降至0.01%。这种信号质量在以往报道的摩擦电设备中从未实现。基于该TIT系统,完成了对人体肢体软组织的可穿戴时序成像。可以实现对肌肉运动和运动意图的动态观察,同时通过TIT设备获取的横截面图像,还能够区分深层组织中的微小异常病变,例如微骨折。凭借优异的生物相容性和轻量化设计,该TIT设备可与医疗辅助外骨骼或智能防护服集成,用于包括软组织运动学分析、深层病变监测甚至康复治疗等多样化的应用。
相关工作以“A wearable triboelectric impedance tomography system for noninvasive and dynamic imaging of biological tissues”为题发表在《Science Advances》(DOI: 10.1126/sciadv.adr9139),博士生杨鹏是论文的第一作者,陈翔宇研究员是该论文的唯一通讯作者,北航袁松梅教授指导了外骨骼机械结构的设计。
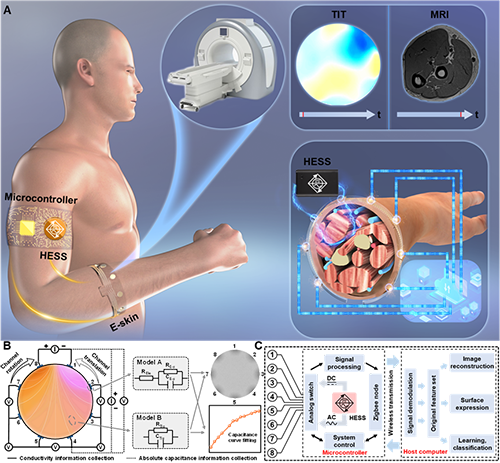
图1:TIT系统的设计方案和系统组件概述。
如图1所示。从硬件角度来看,TIT系统由HESS(用于信号生成)、电子皮肤(e-skin,作为检测器)和微控制器(用于数据处理)组成。电子皮肤收集注入电流的阻抗反馈信息,数据处理模块可快速生成不同软组织的时变导电率图像。针对人体生理结构定制的生物组织阻抗模型对于图像重建至关重要。阻抗网络由两个基本阻抗元件(电极-皮肤(A)和内部组织(B))的耦合连接形成。对于阻抗元件A,电极-皮肤表面之间的电阻(RE-S)和电容(CE-S),以及电极电阻(REle),由电极与皮肤的接触条件决定。阻抗元件B表示内部软组织的阻抗,其中组织在传感位置的电阻(RTis)和电容(CTis)与组织类型和状态相关。因此,组织的生理或病理变化会改变上述电参数,引起局部阻抗变化,从而映射到边界电压。为了获取导电率信息,TIT系统采用四端测量模式,选择两个相邻电极作为电流注入点,并依次从其他相邻电极对收集电压信号。通过改变电流注入策略,并利用对侧电极对进行直流(DC)注入,还可以获得包含人体组织绝对电容值的特性曲线。TIT系统的整体设计方案如上图所示,其中8个电极集成到电子皮肤上,并通过柔性电路与微控制器相连。收集到的生理信息主要在主机计算机上进行处理,实现图像重建及基于机器学习的分类功能。

图2 E-skin和HESS的设计方案和参数表征
附着于人体用于信号输出和数据采集的电子皮肤(e-skin)包括四层功能结构——封装层、支撑层、导电网络和粘附层,总厚度小于10 μm。导电网络采用图案化设计,包括接触电极和蛇形传输线,由Pedot:PSS-聚氨酯(PU)-银纳米线(AgNWs)(PPPA)制成。其余三层功能层则以聚乙烯醇/壳聚糖(PVA/CS)溶液作为基础材料。PVA/CS与猪皮之间的拉伸强度、剪切强度和界面韧性分别为53.16 kPa、72.76 kPa和2.49 J·m?2。这种粘附强度能够在500分钟内提供可靠的附着性能。此外,通过提高AgNWs的长宽比,PPPA的电导率显著提高。而与商业Ag/AgCl凝胶电极相比,电子皮肤在人体上的接触阻抗显著降低,仅为凝胶电极阻抗的35%。
HESS总重量105 g,其中复合摩擦电流源用于提供稳定且高度可控的探测电流。在该复合电流源中,直流模块产生的输出电荷不仅可以独立输出以集成其他医疗设备,还可传输到交流模块来放大并稳定最终输出电流。这种电荷注入方案克服了传统交流摩擦电源响应时间长、稳定性差、抗干扰能力低的缺陷。此外,本研究提出了一种动态平衡策略,用于定量优化HESS的电特性。优化后,DC信号在带宽内的纹波系数低于5%,最低可达0.63%。与商用高压直流电源相比,在相同额定电压下的纹波系数仅为其57%。AC信号的总谐波失真低于1.2%,最低仅为0.03%,表明非基波分量对信号的影响可以忽略不计。输出信噪比高于110 dB,峰值可达120 dB,为TIT系统的高精度检测提供了强有力的保障。同时,AC信号的幅频谱显示,在20-200 Hz范围内,电流强度表现出较弱的频率依赖性,电流振幅在更高频率下基本与频率无关,这有效解决了系统中电流源内部阻抗的频率响应问题。进一步可通过控制PTFE厚度来调节输出阻抗,在人体阻抗测量实验中,HESS的内部阻抗在带宽内被限制到50 MΩ(PTFE厚度:50 μm)。因此,当HESS与人体连接时,其输出电流的变化率仅为0.02%。
微控制器具备64个数据采集通道,紧凑设计为5×5 cm,重量为34 g。采集到的时域信号通过Zigbee传输至主机进行数据处理。不同仪器测得的电压进行时频域比较,验证了微控制器测量的可靠性。在电导率图像重建中,选用一步高斯-牛顿方法作为基本框架,并引入高斯高通滤波器作为正则化算子,确保基于边界电压的电导率分布唯一估计。为减轻基本算法图像重建中的模糊、伪影及幻影边界不准确等特征,将提SDF算法与OGN算法结合,形成SDF-OGN算法。与OGN方法相比,SDF-OGN算法重建的模拟图像形状边界更清晰,同时有效抑制伪影。定量指标(均方根误差(RMSE)、结构相似性指数(SSIM)、峰值信噪比(PSNR)及图像相关系数(ICC))的显著改善进一步证明了这一点。
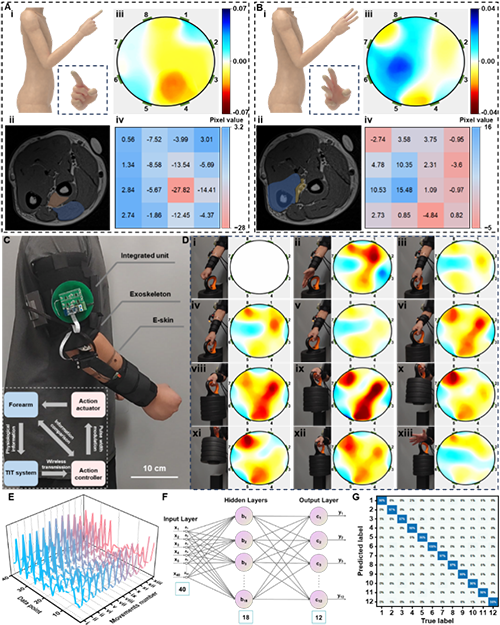
图3 TIT系统对上肢运动的图像重建以及TIT系统与医疗辅助外骨骼的集成。
对于人体内部组织,细胞类型和细胞外液分布显著影响生物组织的电导率,这体现在脂肪(0.021-0.033 S m?1)、血液(0.52-0.83 S m?1)和脑脊液(1.79-1.81 S m?1)等组织的特定电导率上。此外,在不同生理状态下,组织电导率表现出差异,例如肌肉从静止状态过渡到收缩状态时电导率约变化10%。这些在测量横截面上的电导率变化可通过边界电压反馈到TIT系统,进而重建生理状态的变化。在将TIT系统应用于生物组织测量时,注入的电流频率被控制在100 Hz以上。TIT注入人体的电流密度仅为79.58-99.47 mA m?2,显著低于IEC-60601和GB-9706医疗设备标准规定的安全电流阈值。当手部从握拳状态变化为伸出食指时,MRI显示拇长外展肌和示指伸肌发生显著的肌肉变化,同时其他组织也发生了小的形态变化。这一现象同样在TIT图像中体现:红色表示组织电导率的下降,反映了肌肉收缩;而蓝色区域则表明电导率增加,可能归因于肌肉放松或组织位移。MRI与TIT系统均准确反映了主要肌肉收缩的区域,而桡骨和胫骨的形态及位移变化因较小未能在重建图像中捕获。而当手部逐渐伸出食指、中指及无名指时,显著变化出现在深指屈肌及其邻近血管组织中,在TIT图像中表现为相应区域电导率的增加,表明该区域相关组织的放松。随后,TIT设备被集成到医疗辅助外骨骼中,以验证其适用性。图3显示了装有TIT设备的外骨骼,电子皮肤贴附在前臂测试区域。HESS和微控制器经过集成后,通过快速拆卸结构安装在外骨骼上。插图显示了与TIT设备集成的外骨骼的系统框架和控制逻辑。外骨骼的用户,如肌无力患者,尝试完成上肢动作时,与肌肉形状相关的变化以及附近组织的链式反应均可通过TIT系统识别。基于TIT图像与穿戴者运动意图的既定关联,外骨骼可引导产生辅助力量,帮助肌无力患者完成各种动作。通过负载10.5 kg的实验评估集成外骨骼的性能,实验包括12种动作,其中第一个动作为参考动作。当检测到手部抓握时,外骨骼保持静止,表明组织变化未能提供足够的信息预测下一步手臂动作。然而,当提供力量的肌肉的电导率进一步降低,即使实际上未提起重量,TIT系统通过软组织变化映射出运动意图。该信息使外骨骼进入主动状态,从而显著放松相关组织。在接下来的外骨骼辅助上肢运动过程中,TIT系统持续将内部组织信息反馈至控制器,以评估用户的运动意图。将涉及12种动作的运动数据集(80%用于训练集)导入遗传算法优化的反向传播(GA-BP)神经网络。GA-BP网络包括3层,输入层40个神经元,隐藏层18个神经元,输出层12个神经元(图4F)。在12种动作上训练的GA-BP模型平均准确率为97.58%,表现出高识别精度和快速收敛速度。利用基于GA-BP模型的智能增强,集成外骨骼可靠地提供与穿戴者意图一致的力量支持。
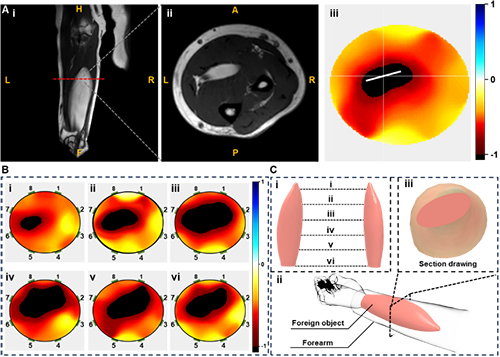
图4 TIT系统重建前臂脂肪瘤的图像并评估成像结果。
与传统可穿戴传感器相比,TIT系统不仅能够识别肌肉运动,还能检测深层软组织的病理性变化。一位前臂脂肪瘤患者参与了病理组织检测研究。脂肪瘤主要由致密脂肪组织组成,其电导率显著低于其他软组织。重建图像证明了TIT系统在评估脂肪瘤的存在、位置和方向方面的可行性。TIT重建图像中病变区域(以黑色显示)略大于MRI观察到的区域,这归因于为增强TIT系统在病变检测中的兼容性而选择了较低的阈值。此外,对健康志愿者与患者的前臂进行MRI和TIT图像的连续比较,以评估不同位置的图像差异。上图展示了TIT系统在不同位置重建的横截面图像,起点位于肘关节下方13 cm处,终点为腕关节。由上图中的图像构建的脂肪瘤3D模型,与MRI建立的3D模型相比,体积差异仅为5%。从包含脂肪瘤的集成前臂模型及其横截面图像可以看出,该模型具有高保真度,满足对病理组织的可视化要求。
本研究介绍了一种用于人体软组织成像的TIT系统,该系统依赖于对人体内不同软组织和可移动生物体液的阻抗信息分析。通过结合专门定制的微控制器和机器学习优化的重建算法,目标横截面内的阻抗分布可以用于实现生物组织的无创成像以及异常组织的识别。高质量且生物相容的电流信号源是TIT系统的核心组成部分。本研究提出了一种具有特殊设计的直流-交流放大策略的复合电流源作为扫描信号源。包括摩擦电源、电机和控制电路在内的信号源被集成到一个尺寸为9 cm×9 cm×2 cm的模块中。在复合电流源驱动下,该HESS获得了4-5 μA的电流强度,表现出仅为0.03%的最小总谐波失真和高达120 dB的峰值信噪比。注入人体的电流密度仅为79.58-99.47 mA*m?2,输出电流的变化仅为0.02%,远低于IEC-60601和GB-9706医疗设备标准规定的安全电流阈值。
TIT系统在实际测试中表现出平均SSNR为102 dB,结合本研究开发的SFD-OGN算法,TIT系统实现了1 mm/50 mm的最大测量空间分辨率,并获得了成像精度98.18%和ICC值0.9995的高保真成像结果。在此情况下,TIT系统可以区分肘关节周围的前臂提拉动作,最小检测角度低至3°。TIT系统与医疗辅助外骨骼的集成实验表明,TIT设备能够高效识别用户的运动意图,平均识别精度达95.4%,从而指导外骨骼辅助肢体运动。除了肌肉运动外,TIT设备还能检测软组织的深层病理变化。通过TIT系统扫描前臂脂肪瘤的阻抗信息生成的3D建模结果,与MRI结果相比,其体积差异仅为5%。结合绝对电容分析,TIT系统还可以快速完成前臂闭合性损伤微骨折的检测任务。本研究提出的TIT系统,为人机交互、外骨骼辅助治疗、户外医疗等领域的各种应用提供了支持,展现了广阔的应用前景。
原文链接:https://www.science.org/doi/10.1126/sciadv.adr9139




