肿瘤细胞的自修复机制,例如热休克蛋白(HSP)应激性上调等,严重影响现有抗肿瘤疗法的治疗效果。目前主要使用小分子抑制剂解除肿瘤细胞的自修复机制,然而其临床应用受限于脱靶毒性、抗肿瘤疗效不足等问题。因此,如何开发选择性解除肿瘤细胞自修复机制的策略,安全高效地放大肿瘤协同治疗效果成为当前研究的热点与难点。
近年来,苏州大学药学院陈华兵/杨涛教授团队围绕肿瘤光治疗及其协同效应开展了一系列研究(Adv Mater, 2021, 33, 2004225; Adv Mater, 2021, 33, 2100795; J Control Release, 2022, 350, 761; Adv Mater, 2023, 35, 2210201)。在上述研究基础上,该团队近期与孙晓辉副教授等合作,发现TRPV1离子通道阻断策略能有效抑制光热应激条件下肿瘤细胞的钙离子内流,进而通过热休克因子1(HSF1)调控HSP70、TGFβ等,从而解除肿瘤细胞的自修复作用,有效增敏肿瘤光热治疗及其免疫协同治疗效应,显著提升了难治性肿瘤如胰腺癌等的抑瘤效应。该工作以题为“Nanoparticle-mediated TRPV1 channel blockade amplifies cancer thermo-immunotherapy via heat shock factor 1 modulation”发表于Nat Commun,苏州大学药学院陈华兵教授、孙晓辉副教授和杨涛教授为共同通讯作者。

在此基础上,进一步构建了吲哚菁绿、TRPV1阻断剂共递送的聚合物胶束(IS-Micelles,42.8 nm,图2A)。该聚合物胶束在结肠癌模型、大肿瘤模型(250-300 mm3)以及原位肿瘤模型中均表现出显著的抗肿瘤作用(图2B-D)。此外,IS-Micelles治疗组对正常组织的HSP70表达没有明显影响,而作为对照的HSP70分子靶向药物则诱导了正常组织HSP70水平的下调(图2E)。此外,IS-Micelles治疗组对心、肝以及肾功能指标等没有显著影响(图2F),明显优于HSP70分子靶向药物,这提示TRPV1离子通道阻断策略具有良好的体内安全性。

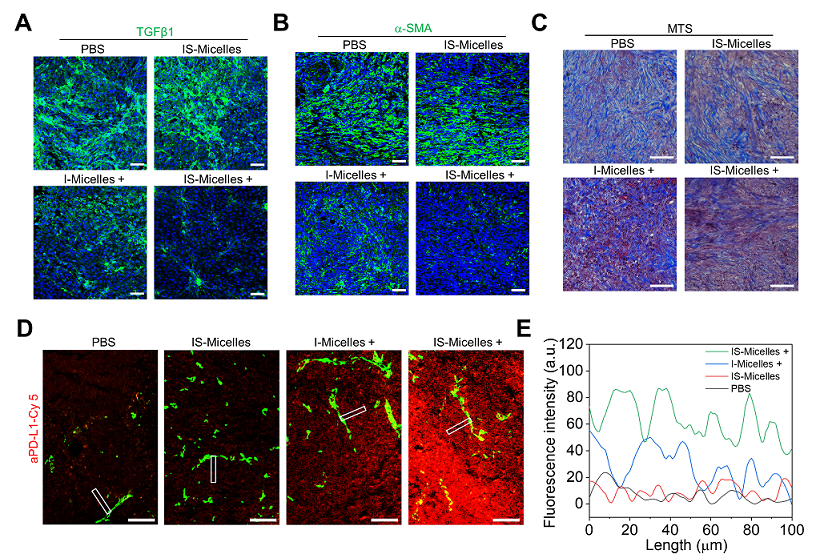
同时,还发现IS-Micelles具有明显的肿瘤细胞外基质调控功能。其介导的光热治疗及TRPV1离子通道阻断功能显著抑制胰腺癌组织中TGFβ1的表达(图3A),使肿瘤部位的成纤维细胞比例下调(图3B),肿瘤细胞外基质的纤维化水平降低(图3C),从而有助于aPD-L1抗体在PANC02胰腺癌中的瘤内浸润(图3D、E)。上述结果表明,IS-Micelles有望与免疫检查点阻断疗法产生协同治疗作用。
抑瘤实验证实,IS-Micelles与aPD-L1抗体组合治疗时显著抑制了PANC02原位胰腺癌肿瘤模型的生长(图4A),并有效延长了荷瘤小鼠的生存周期(图4B)。同时,这种组合治疗策略可下调髓源抑制性细胞比例(图4C),诱导M2型巨噬细胞极化为M1表型(图4D),促进树突状细胞成熟(图4E),提升细胞毒性T细胞和自然杀伤性细胞的肿瘤浸润比例(图4F、G),从而重塑肿瘤免疫微环境,实现了高效的热免疫协同治疗。

上述结果表明,基于纳米粒的TRPV1离子通道阻断策略可有效解除肿瘤自修复机制,并通过调控肿瘤微环境及免疫抑制微环境高效增敏肿瘤热免疫治疗。该工作揭示了离子通道在调控肿瘤细胞自修复机制中的关键作用,为肿瘤治疗提供了一种安全、高效的增敏新方法。
论文信息:Ting Li#, Shuhui Jiang#, Ying Zhang, Jie Luo, Ming Li, Hengte Ke, Yibin Deng, Tao Yang*, Xiaohui Sun*, Huabing Chen*, Nanoparticle-mediated TRPV1 channel blockade amplifies cancer thermo-immunotherapy via heat shock factor 1 modulation. Nat Commun, 2023, 14, 2498. DOI: 10.1038/s41467-023-38128-x
https://doi.org/10.1038/s41467-023-38128-x
通讯作者简介:

陈华兵,苏州大学二级教授、博士生导师、药学院副院长,国家自然科学基金杰出青年科学基金(2021年)及优秀青年科学基金(2014年)获得者、江苏省双创计划人才(2014年)、教育部青年长江学者(2016年)、姑苏创新创业领军人才(2022年)。担任《药学学报》、《Nanomaterials》、《Sci China Chem》、《Sci Bull》及《Asian J Pharm Sci》等期刊青年编委或客座编辑、以及国家级一流本科课程《药剂学》(线上)建设负责人。被选为中国药学会纳米药物专业委员会委员、中国抗癌协会纳米肿瘤学专业委员会常务委员等。主要从事用于抗肿瘤药物靶向输送的纳米药物载体及其创新制剂研究,团队现有教授3人、副教授4人及研究生近30人。迄今为止,发表SCI论文70余篇,其中作为通讯作者在Adv Mater、Nat Commun、ACS Nano、Adv Funct Mater、Biomaterials、J Control Release等杂志上发表影响因子大于10的通讯作者论文30余篇,ESI高被引论文10余篇;获已授权中国发明专利20余项;近年来,主持国家自然科学基金杰出青年科学基金、科技部重点研发计划课题及省市项目十余项。

孙晓辉,苏州大学副教授。主要从事离子通道结构、功能和药理的相关研究,近年来的研究兴趣聚焦于离子通道在肿瘤及神经炎症中的作用和机制,以通讯作者或第一作者(含共同)在Nat Commun、J Biol Chem、J Neurosci、Biomaterials等发表SCI论文8篇,论文他引次数超过1000,主持国家自然科学基金一项。

杨涛,苏州大学特聘教授、博导。2018年于苏州大学获得药剂学博士学位,随后前往Innovation Center of Nanomedicine从事博士后研究,合作导师为美国科学院外籍院士、ACS Nano副主编、纳米医药先驱Kataoka教授。杨涛博士于2021年12月加入苏州大学药学院,主要从事智能化药物递送、免疫创新制剂的研发,作为通讯作者/第一作者(含共同)在领域内高水平期刊Nat Biomed Eng、Nat Commun、Adv Mater、ACS Nano、Biomaterials、J Control Release等发表影响因子大于10的SCI论文13篇,其中ESI高被引论文3篇;作为主持人承担了国家自然科学基金委、日本学术振兴会、江苏省双创计划、姑苏创新创业领军人才等多项科研及人才项目;申请发明专利9项,包括3项国际专利和已授权专利2项。受邀担任Pharmaceutics杂志客座编辑(Guest Editor)、Frontier In Oncology杂志评审编辑(Review Editor)。被选为中国抗癌协会纳米肿瘤学青年专业委员会常务委员。
- 中国海大何治宇/于良民 Adv. Sci.:基于传统中药冰片的聚合物胶束脑内药物递送系统-用于精确适应病理机制的缺血性脑卒中治疗 2025-01-21
- 复旦大学占昌友教授团队《Nano Today》:亲和诱捕法实现生物介质中PEG化聚合物胶束的高效分离-破译聚合物胶束的体内命运 2024-04-25
- 国科大屈小中教授课题组 Angew:在高分子-蛋白多层次结构纳米组装体制备和应用研究中取得进展 2024-02-27
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
