为了实现预防、诊断、治疗等药效功能,生物大分子药物往往需要穿透细胞膜进入胞内,但递送过程中需要穿透细胞膜等生物屏障。光介导的胞内递送方法由于其良好的通用性和调控性,能够适用于多种生物药物以及各类细胞的递送,得以被广泛关注和研究。传统的光穿孔通过激光聚焦于细胞膜上形成短暂的微小膜孔,无法实现高通量的递送。为了解决该问题,利用光热纳米材料介导的光穿孔技术显著提高了生物大分子的递送效率。
近日,南京林业大学黄超伯/熊燃华教授团队受邀在国际权威期刊《Accounts of Chemical Research》发表题为“Photothermal Nanomaterial Mediated Photoporation”的综述论文。熊燃华教授为本文第一作者兼通讯作者。该成果得到了国家自然科学基金优青年基金(海外)项目、国家自然科学基金面上项目等资助。熊燃华教授长期从事于纳米材料与光协同增强功能性生物大分子的胞内递送研究,并取得一系列研究成果(ACS Nano, 2014, 8, 6288–6296; ACS Nano, 2018, 12, 7791?7802;Advanced Materials, 2021, 33(27): 2008379; Nature Nanotechnology, 2021, 16(11): 1281-1291; Chemical Society Reviews, 2021, 50(9): 5746-577; Nature Communications, . 2022, 13(1), 1996;),对光穿孔技术的发展具有重要意义。
本文首先介绍了光穿孔的概念和历史发展。根据作者在该领域十多年的研究经验,将光热纳米材料分为单一纳米结构和复合纳米结构。然后,深入讨论了用于光穿孔的各类型光热纳米材料,对各类型光热纳米材料从其合成、表征到光穿孔技术的应用进行了详细讨论,并指明了其优点和缺点。最后,阐述了光穿孔技术的未来探索方向。
1.单一纳米结构
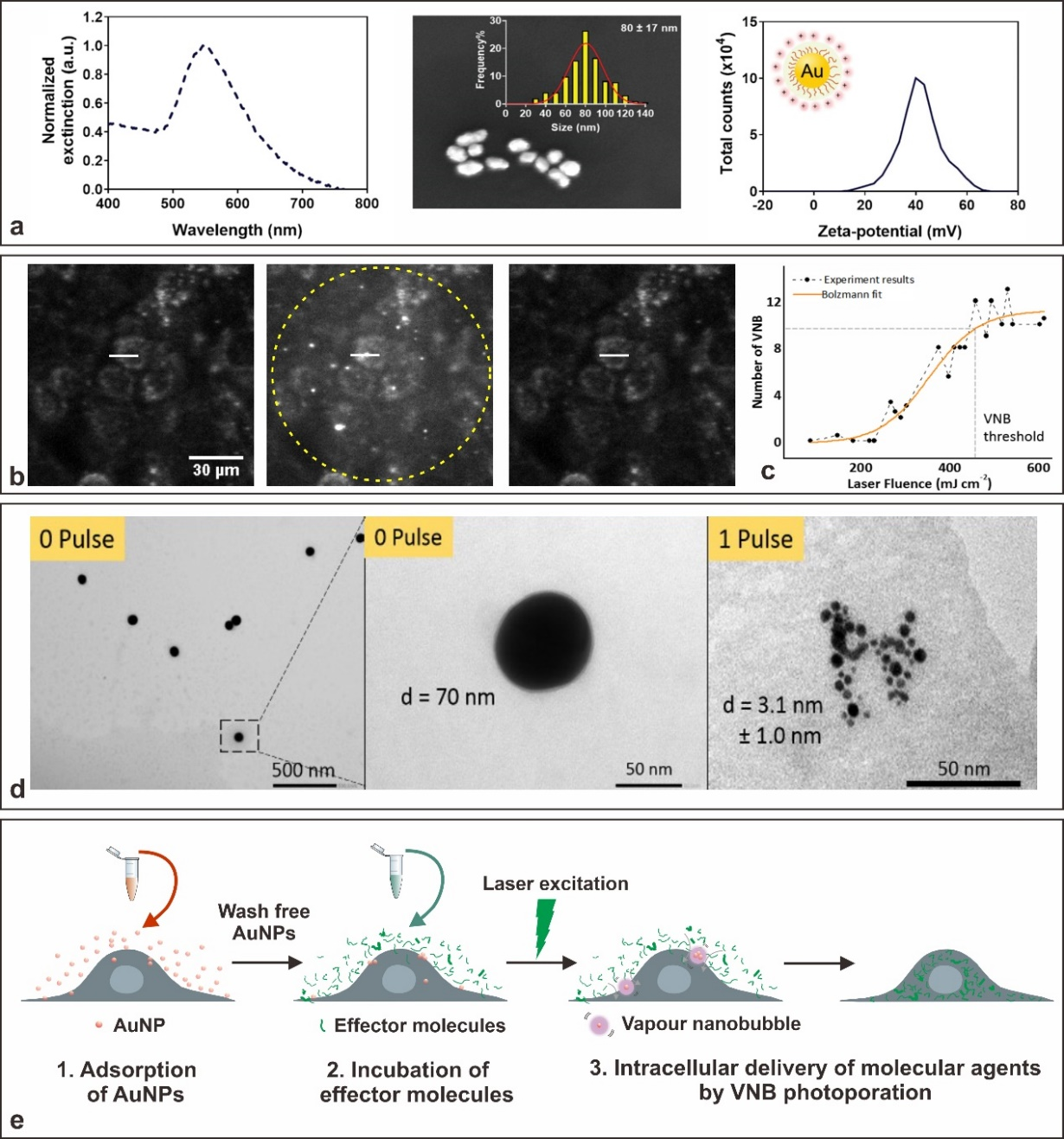
图1.金纳米颗粒介导的光穿孔。(a)约为80nm的PDDAC@AuNPs的UV-VIS光谱,具有尺寸分布和Zeta电位的SEM图像。(b)在细胞与PDDAC@AuNPs.细胞显示在激光照射之前、期间(VNB可见为亮点)和之后。虚线圆圈标记激光照射区域。(c)VNB阈值的确定PDDAC@AuNPs。(d)TEM图像PDDAC@AuNPs在1个激光脉冲(0.94J/cm2,7ns,561nm)之前(0脉冲)和之后,显示AuNP在激光照射之后变得碎片化。(e)AuNP介导的光穿孔的实验程序的示意性概述。
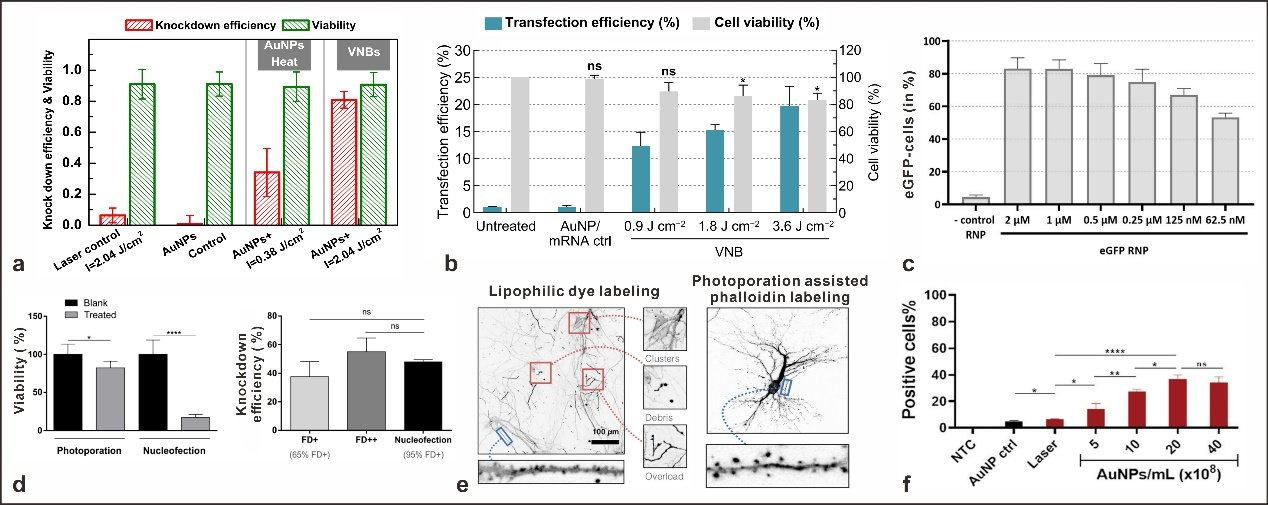
图2.通过AuNP介导的光穿孔在各种细胞类型中递送效应分子。(a)AuNP介导的H1299-eGFP细胞的光穿孔,具有用于siRNA基因沉默的不同激光强度。24小时后用流式细胞术定量eGFP表达。(b)0.3 μM eGFP-mRNA通过AuNP介导的光穿孔在HeLa细胞中转染,使用增加的激光通量和8×107 NPs/mL的固定AuNP浓度。(c)在eGFP RNPs浓度降低的情况下,光穿孔后H1299中eGFP敲除水平。(d)通过AuNP介导的光穿孔与电穿孔(核感染)在细胞毒性T淋巴细胞(CTL)中的细胞活力和基因沉默。(e)通过与亲脂性染料DiI孵育标记初级神经元的结果导致显微镜图像中的染色伪影,例如细胞中存在碎片和不均匀染色。相反,通过光致孔在细胞内递送鬼笔环肽导致所选神经元细胞的高质量染色。(f)在1.6J/cm2的激光通量下用150kDa的FITC葡聚糖进行AuNP介导的巨噬细胞光穿孔,以增加AuNP浓度。
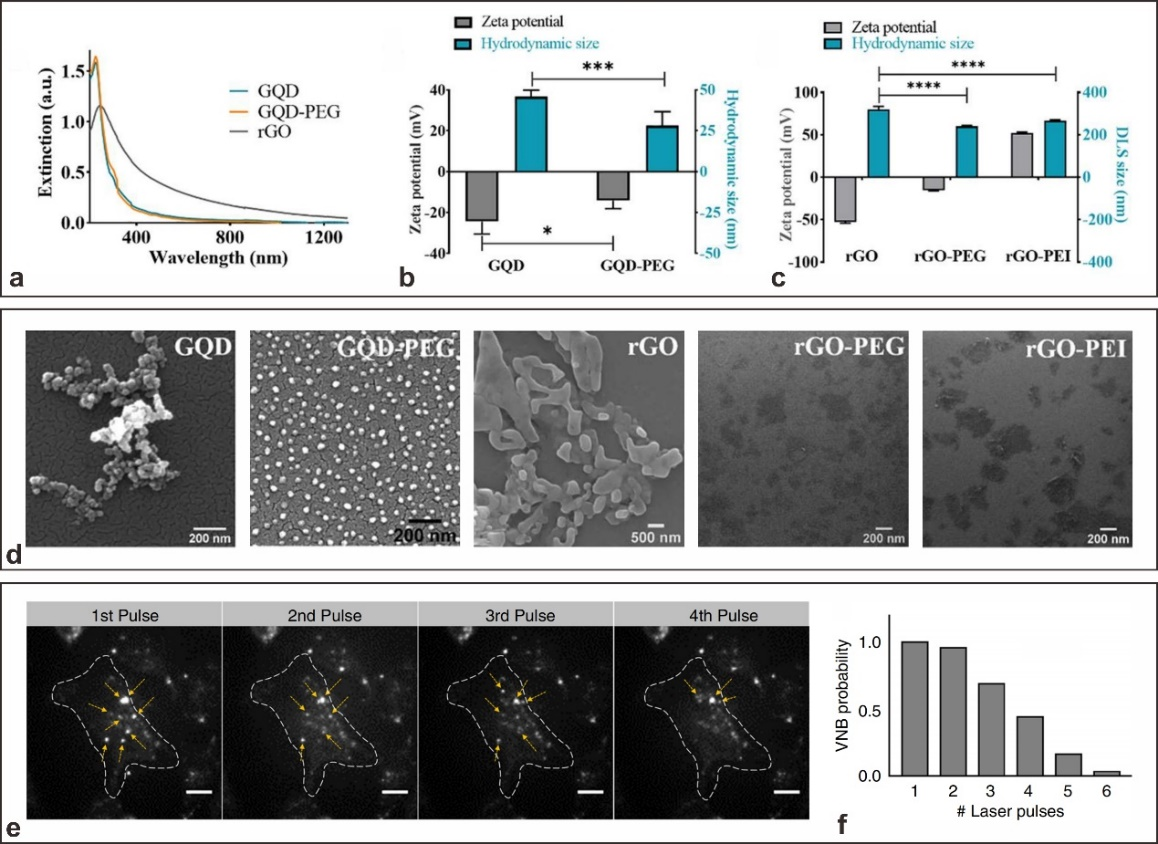
图3.GQD和rGO的物理化学性质和重复VNB形成。(a)GQD、GQD-PEG和rGO的UV-NIR消光光谱。(b)通过DLS测量的GQD和GQD-PEG的Zeta电位和流体动力学尺寸。(c)rGO、rGO-PEG和rGO-PEI的Zeta电位和流体动力学尺寸。(d)GQD、GQD-PEG、rGO、rGO-PEG和rGO-PEI的SEM图像。(e)暗场图像显示HeLa细胞上的GQD,并以两倍于VNB生成阈值(7ns,561nm)的4个离散激光脉冲照射。对于每个后续激光脉冲,可以观察到VNB的重复形成(黄色箭头);虚线和比例尺中突出显示的细胞边界为20μm。(f)GQD在重复暴露于激光脉冲时重复形成VNB的概率。
当涉及到光穿孔的临床转化时,AuNPs或碳基NPs存在着安全降解以及碎裂的潜在毒性。因此,他们探索了可生物降解的光敏剂,如氧化铁纳米颗粒(IONPs)、黑磷量子点(BPQDs)或有机聚多巴胺纳米颗粒(NPs)进行光穿孔的可能性(图4)。IONPs已被临床批准为磁共振成像(MRI)造影剂,被细胞摄取后可被多种水解酶(如溶酶体组织蛋白酶L)在体内降解。在该工作中,使用500nm大小的市售磁性纳米颗粒(MagPs)并进行PEI涂层官能化。通过在巨噬细胞中递送FD150,将MagPs的光穿孔与AuNPs进行比较。使用优化的MagP浓度为10×107MagPs/mL,激光通量为0.84J/cm2,获得51%的阳性细胞,rMFI为9,细胞存活率约为80%(图4a-b)。表明IONPs是AuNPs的一种可行替代品,在巨噬细胞上具有更好的性能。在另一项研究中,使用了可生物降解的BPQDs作为光敏剂。通过超声法剥离大块BPQD合成尺寸约20 nm BPQDs,并用25kDa PEI或500kDa PEG官能化。其在250 nm到850 nm的具有宽近均匀吸收光谱和高光热转换效率(图4c-d)。当使用可见光(532nm)和近红外(800nm)激光照射时,能够成功实现光穿孔。当使用0.4μg/mL的mRNA浓度时,HeLa细胞中转染效率为53%。有趣的是,BPQD介导的光穿孔当使用NIR激光照射代替可见光(561nm)在厚体模组织的细胞中递送大分子时,递送效率提高约50%。
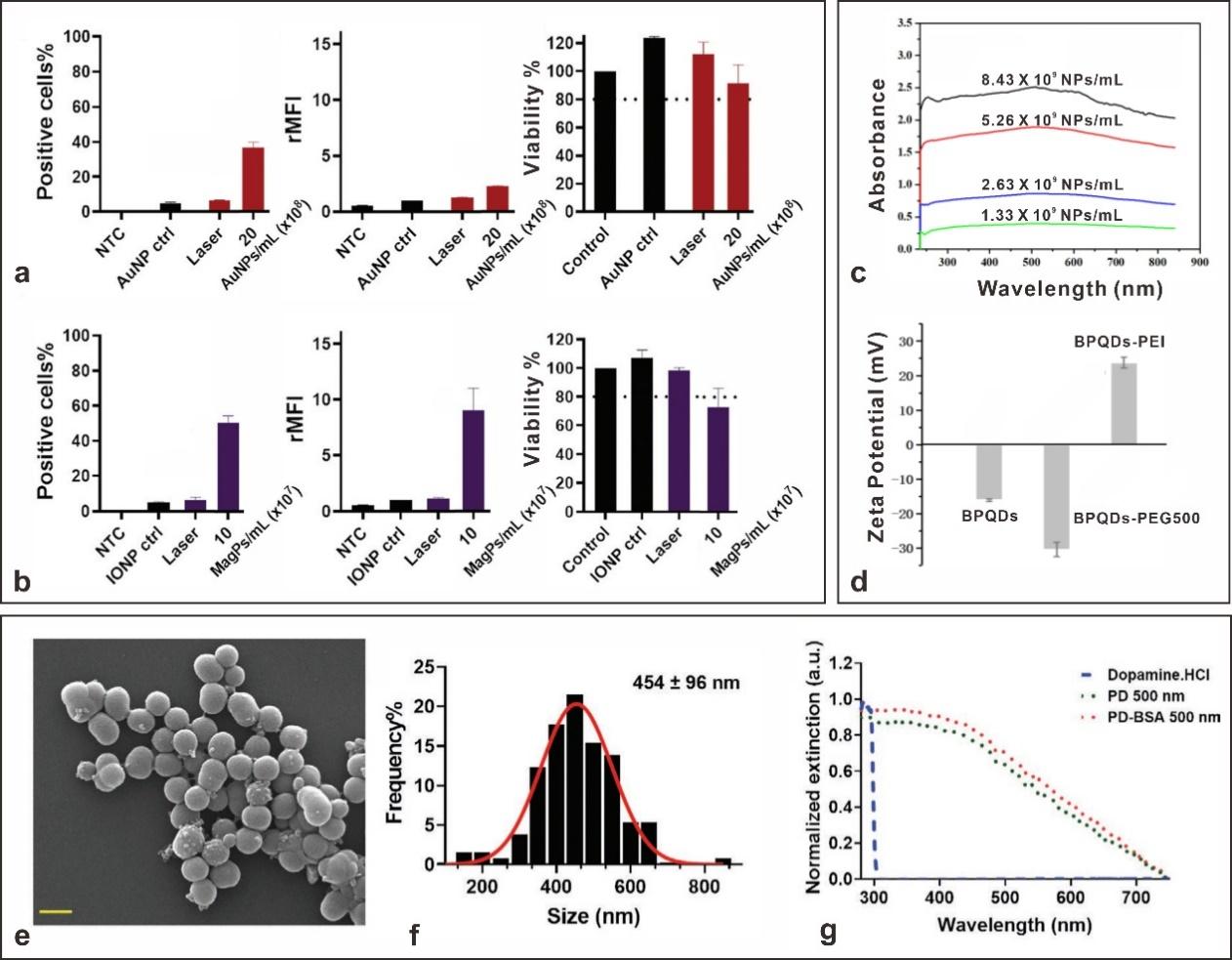
图4.可生物降解纳米颗粒的光汽化,包括MagPs、BPQDs和PD NPs。(a-b)150kDa的FITC-葡聚糖(FD150)通过与AuNP(a)和MagPs(b)的光穿孔在巨噬细胞中递送。递送效率表示为FD150+细胞的百分比。与未处理的细胞相比,相对平均荧光强度(rMFI)表示每个细胞的平均荧光。通过光穿孔后6小时的代谢WST-1细胞活力测定来测量细胞活力。(c-d),水中几种浓度下的BPQD UV-VIS吸收光谱(c),以及具有500kDa聚乙二醇(BPQD-PEG500)或25kDa聚乙烯亚胺(BPQD-PEI)的原始和官能化BPQD的Zeta电位(d)。(e-g)裸的或BSA涂覆的PD NP的物理化学表征。(e)约500nm PD NP的SEM图像(比例尺500nm)以及通过图像处理(f)确定的对应尺寸分布;(g)盐酸多巴胺、裸PD NPs和PD-BSA的UV-VIS消光光谱。
2.复合光热纳米结构:
纳米光敏剂光穿孔的细胞内递送依赖于外部分子通过所形成的膜孔被动流入细胞。由于孔处的扩散迁移率和空间位阻较慢,在大分子的胞内递送中尺寸的增加变得越来越困难。为了提高mRNA和pDNA等大货物分子的递送效率,他们开发了一种复合纳米结构,称为纳米炸弹,以在细胞膜中形成更大的孔。纳米炸弹由光热核颗粒制成,并涂有较小的纳米颗粒,用作纳米弹丸。脉冲激光照射后,光热核心粒子迅速加热,形成蒸汽泡,其机械力将推动外部纳米射弹穿过附近细胞的细胞膜(图5a)。这允许通过控制纳米弹丸的大小来调整产生的孔隙大小。使用直径为0.5μm MagP颗粒作为核粒子。通过链霉亲和素功能化,允许直接偶联生物素化纳米弹丸,包括荧光聚苯乙烯纳米球、聚乳酸-羟基乙酸(PLGA)NP和TiO2 NP。纳米炸弹的光穿孔是按照与传统纳米敏化剂类似的程序进行的。mRNA和pDNA通过光触发NBs在粘附的HeLa和悬浮的Jurkat细胞中成功地进行了细胞内递送。证明了纳米炸弹光穿孔能够用mRNA和pDNA转染贴壁和非贴壁细胞,且转染率优于电穿孔5.5–7.6倍。

图5.复合光热纳米结构的光汽化,包括纳米炸弹和光热纳米纤维。(a).光触发纳米炸弹由光热核心粒子(蒸汽泡源)组成,纳米射弹与光热核心粒子结合。在强激光脉冲照射下,形成VB,其机械力将推动纳米弹丸穿过附近细胞的质膜。存在于细胞培养基中的外来分子,如mRNA,可以迁移到细胞的细胞质中。(b)通过光热纳米纤维的膜透性进行细胞内递送的示意图。
总结与展望:
光热纳米材料介导的光穿孔技术作为一种相对较新的方法,将效应分子输送到活细胞中,近年来越来越受到关注。在过去的十年中,团队广泛探索了各种光热纳米材料作为光穿孔的敏化剂,每一种都有其独特的好处。此外,针对光穿孔技术的未来发展还可以从以下方向进行探索:
(1)需要进一步基础研究潜在的光穿孔中的孔形成机制,包括光热纳米颗粒向环境的热传递、纳米气泡动力学和细胞修复机制。
(2)光穿孔是一项成熟的体外转染技术,已被证实对细胞非常温和,在货物和细胞类型方面具有广泛的适用性。有望在体内实现直接的光穿孔。
(3)光穿孔在具有多层刚性细胞壁植物细胞中的应用有望被探索。
(4)利用激光诱导的纳米微泡应用于扰动其他生物组织将具有重要意义。
全文链接:https://doi.org/10.1021/acs.accounts.2c00770
实验室主页:https://www.x-mol.com/groups/nfu-ugent
- 暂无相关新闻
