生物医用水凝胶的湿粘附性能是其长效服役于生理环境的关键。在生理环境中,水分子在组织表面形成水化层,这阻碍了水凝胶中粘附分子和组织之间的界面接触。此外,水分子会破坏水凝胶和组织之间的粘附力。近年来,基于贻贝粘附蛋白疏水端基和儿茶酚基团协同的水下粘附机理被广泛关注。然而,儿茶酚衍生物和疏水基团种类繁多,水凝胶体内服役环境复杂,导致仿贻贝湿粘附水凝胶研发成本高、周期长,而且大量研究数据呈现碎片化特征,缺乏系统性和可比较性。因此,仿贻贝湿粘附水凝胶复杂的分子-结构-性能关系给其设计带来了巨大的挑战,严重制约了生物医用水凝胶的研发进程。
材料基因组计划提出了将高通量实验、理论计算和数据库技术融合的策略,通过大数据技术优化筛选材料的组成和结构以得到更好的目标性能,可加快材料从设计、构建到应用的研发速度、降低研发成本。近日,西南交通大学医学院鲁雄教授、谢超鸣研究员和成都大学张红平研究员基于材料基因组方法,借鉴贻贝水下粘附机理,利用高通量实验和理论计算,一次性构建了多种不同长度烷基链的疏水单体和儿茶酚衍生物组合的仿贻贝水凝胶,并对其湿粘附力进行了优化和筛选。结果表明,仿贻贝水凝胶的湿粘附力在很大程度上取决于疏水烷基链的长度:在水凝胶网络中,较短长度的疏水烷基链具有较强的湿粘附强度,其通过有效地“排除”界面水分子,使得儿茶酚基团与基底接触;而较长的疏水烷基链在水凝胶网络通过强疏水相互作用形成“缠节”导致水凝胶网络的刚性增加,界面“排水”能力减弱,降低了对外力的耗散能力,最终使得湿粘附强度降低。
除了揭示儿茶酚与烷基链对仿贻贝水凝胶湿粘附力的影响,他们发现该水凝胶还具有超强止血和免疫调节的生物学效应,并结合高通量生物学评价,探讨了儿茶酚和烷基链影响水凝胶生物学效应的机制。儿茶酚与烷基链激活 αvβ3和α5β1 整合素,通过Rac和ROCK/MLC/myosin II通路协同促进细胞粘附和铺展。更重要的是,随着网络中儿茶酚的加入,水凝胶表现出良好的免疫调节能力,可以抑制炎症,并减轻排异反应。此外,在将多巴胺修饰的导电碳纳米管(pCNT)引入网络后,水凝胶作为湿粘附电极被集成到可穿戴设备上,可用于在游泳期间连续监测人体心电图,以及对活体猪心脏进行原位电刺激及监测。综上,该工作表明利用高通量制备与表征,结合理论计算,通过调控水凝胶关键分子和结构优化和筛选其物理化学及生物学性能,可变革传统水凝胶的研发理念和模式,加速生物医用水凝胶的研发。
相关研究以 “Tuning Water-Resistant Networks in Mussel-Inspired Hydrogels for Robust Wet Tissue and Bioelectronic Adhesion”为题发表在《ACS Nano》。西南交通大学医学院鲁雄教授、谢超鸣研究员和成都大学张红平研究员为共同通讯作者。西南交通大学博士研究生侯跃为论文的第一作者。该工作得到了国家自然科学基金、四川省重点研发计划等项目支持。
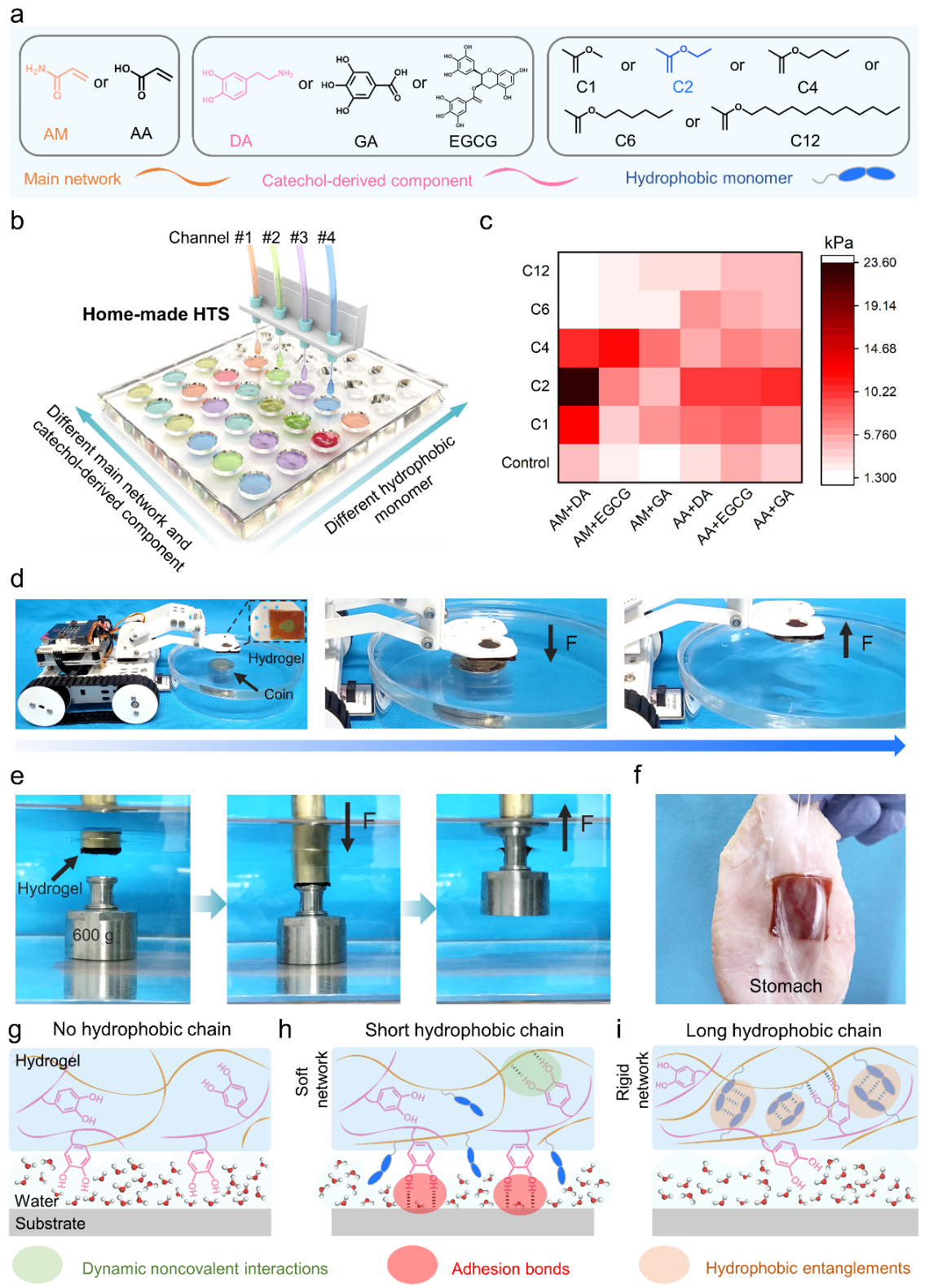
图1. 基于不同长度疏水单体和儿茶酚衍生物组合对仿贻贝湿粘附水凝胶进行高通量筛选。(a) 不同水凝胶的成分:主网络(丙烯酰胺(AM)和丙烯酸(AA))、儿茶酚衍生物(多巴胺(DA)、没食子酸(GA)和表没食子儿茶素没食子酸酯(EGCG))和疏水单体(丙烯酸甲酯 (C1)、丙烯酸乙酯 (C2)、丙烯酸丁酯 (C4)、丙烯酸己酯 (C6) 和丙烯酸十二烷基酯 (C12))。 (b) 自制高通量筛选系统示意图。 (c) 不同水凝胶对湿玻璃表面的湿粘附强度。(Control:不添加疏水单体)(d) 将湿粘附水凝胶集成到遥控车上,以快速从水中拾取轻物体。 (e) 湿粘附水凝胶用于从水中粘附和拾取重物。 (f) 湿粘附水凝胶在水冲洗下稳定地粘附在猪胃上。(g-i) 不同组合的仿贻贝水凝胶的湿粘附机制示意图。
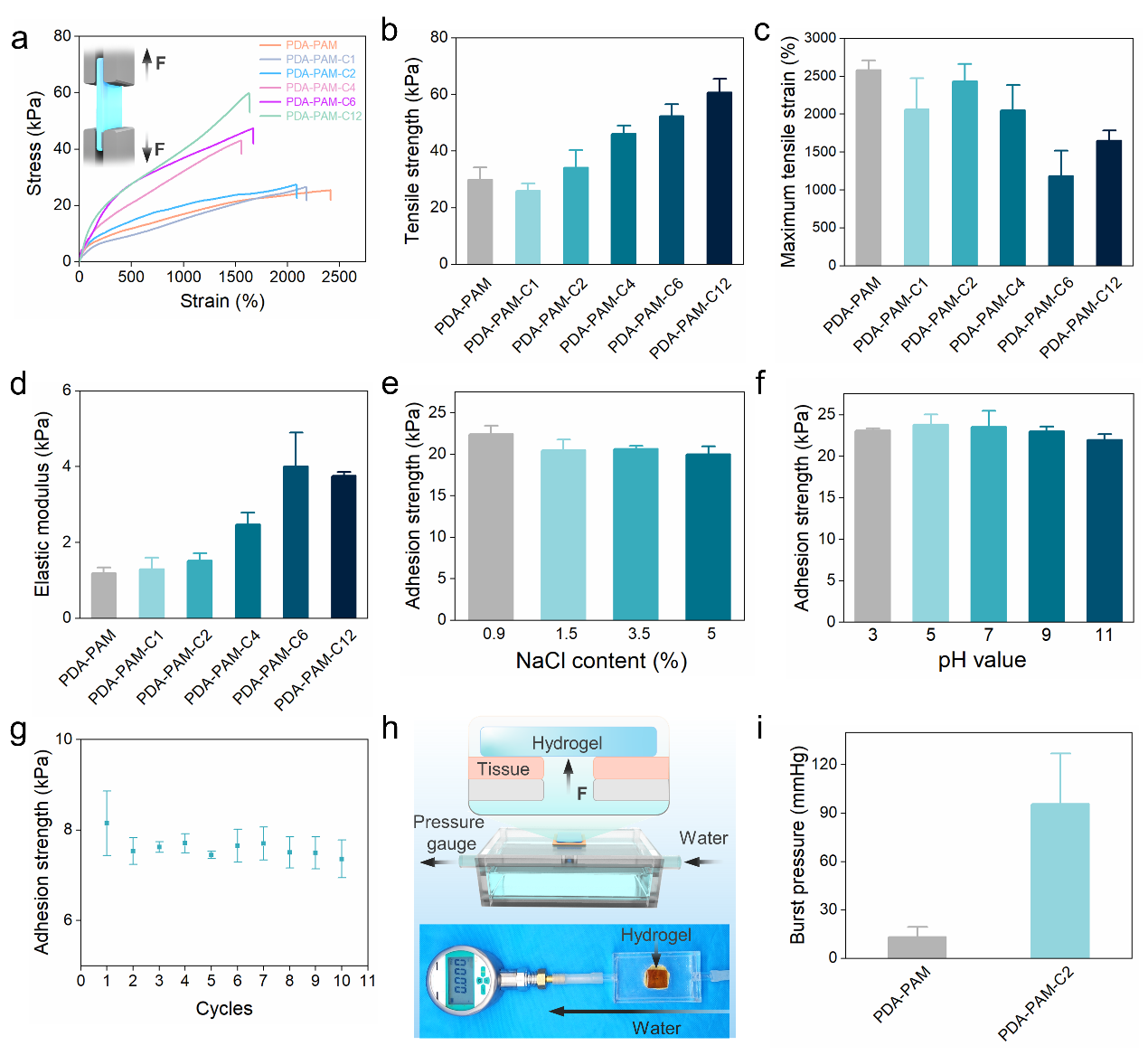
图2. 水凝胶的机械性能。(a)拉伸应力-应变曲线,(b) 拉伸强度,(c) 拉伸应变,和 (d) 不同水凝胶的弹性模量。PDA-PAM-C2 水凝胶在具有 (e) 不同离子浓度和 (f) pH 值的液体环境中对玻璃的湿粘附强度。(g) PDA-PAM-C2 水凝胶对猪皮肤的重复湿粘附强度。(h) 爆破压力测试示意图。(i) PDA-PAM 和 PDA-PAM-C2 水凝胶的爆破压力。
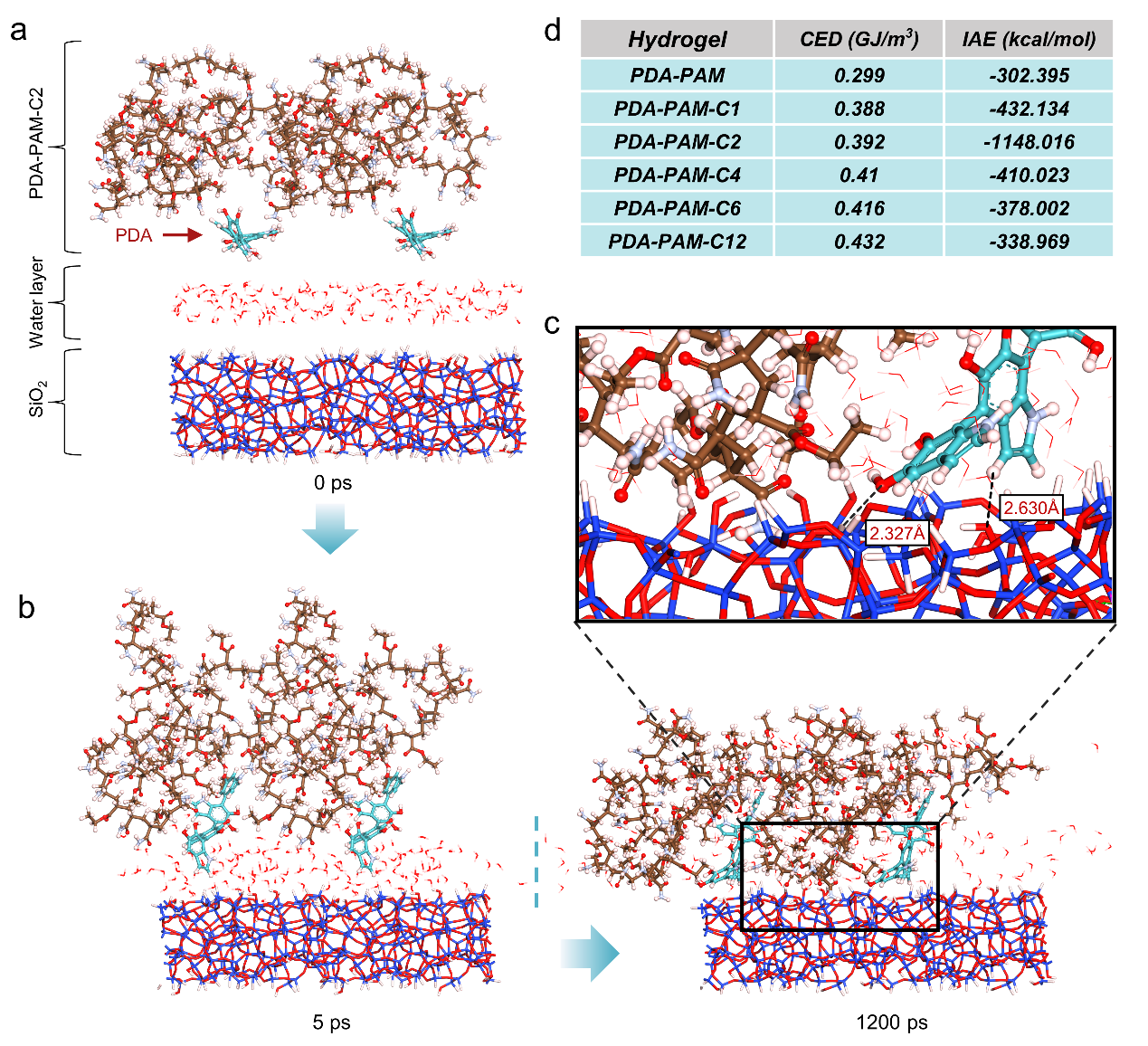
图3. PDA-PAM-C2 水凝胶在具有水层的玻璃表面上的湿粘附过程的分子动力学 (MD) 模拟。(a) 初始状态 (0 ps)。(b) 中间状态 (5 ps)。(c) 最终状态 (1200 ps)。(d) 湿玻璃表面不同水凝胶的 CED 和 IAE 计算值。
PDA-PAM-C2 水凝胶具有儿茶酚基团和疏水性官能团,表现出细胞亲和性并促进细胞粘附。通过高通量转录组测序发现GO富集分析中上调的基因有许多与细胞粘附相关。KEGG通路富集分析显示, “肌动蛋白细胞骨架调节(regulation of actin cytoskeleton)”、“粘着斑(focal adhesion)”和“粘附连接(adherens junction)”通路显着上调,这都表明 PDA 和 C2 促进了 L929 细胞的粘附。细胞粘附相关基因表达的差异显示整合素相关基因被 PDA-PAM 和 PDA-PAM-C2 水凝胶上调,这表明 PDA 诱导 α5β1 整合素的显着表达。对于 PDA-PAM-C2,αvβ3 整合素比其他组上调更多,表明 PDA 和 C2 对细胞粘附具有协同作用。另一方面,大多数粘着斑蛋白相关基因在 PDA-PAM 和 PDA- PAM-C2 水凝胶显著上调,与这些水凝胶上增加的细胞粘附相匹配。

图 4. 湿粘附水凝胶的细胞粘附性。(a) 培养第 3 天不同水凝胶上细胞的 CLSM 图像。蓝色:细胞核,绿色:粘着斑。(b) 不同水凝胶上每个细胞的粘着斑面积。 (c) PDA-PAM-C2 与 PAM 水凝胶中所有基因的 GO 分析。 BP:生物过程,MF:分子功能,CC:细胞成分。 (d) PDA-PAM-C2 与 PAM 水凝胶的富集 KEGG 通路。 (e-g) 差异表达基因的热图分析。 (h) PDA-PAM-C2 水凝胶上细胞粘附机制的示意图。

图 5. 水凝胶的止血性能。(a) 猪的止血模型示意图。(b-d) PDA-PAM-C2 水凝胶对猪(b)动脉、(c)心脏和(d)肝脏止血性能的照片。白色箭头:血液,绿色箭头:水凝胶。(e) 在大鼠肝出血模型中使用不同水凝胶进行手术和止血的照片。 (f) 180 秒后每种水凝胶的出血量。(g) 不同水凝胶上红细胞的 SEM 图像。(h) 不同组的凝血指数。(i) PDA-PAM-C2 水凝胶的止血机制。

图 6. 水凝胶的体内免疫调节和伤口修复能力。(a) 在 SD 大鼠皮下植入 14 天后,水凝胶周围组织中炎症和异物反应标志物的免疫荧光图像。蓝色:细胞核,红色:α-平滑肌肌动蛋白 (α-SMA) 和 T 细胞 (CD3)。(b) 第 1 天和 (c) 第14天免疫荧光图像的荧光强度。RAW 264.7细胞在不同水凝胶上的 (d) M1相关标记物和 (e) M2相关标记物的表达水平。(f) 在不同时间不同组处理的伤口的照片。(g) 14天后每组切片的苏木精和伊红染色。绿色箭头代表伤口部位新形成的毛囊和胶原蛋白。(h) 新表皮组织厚度的量化。(i) 水凝胶伤口愈合机制示意图。

原文链接:https://doi.org/10.1021/acsnano.2c11053
- 华南理工大学宋文婧/任力团队 AHM:一种通过调控交联网络形成顺序用于显著提升粘合剂长效湿粘附性能的策略 2025-03-26
- 四川大学李继遥/梁坤能/杨佼佼 CEJ:贻贝启迪的湿粘附长效抗菌水凝胶用于牙周炎的治疗 2025-03-12
- 北京化工大学徐福建教授团队 AM:可适应强湿粘附水凝胶用于长期保护牙周炎伤口 2024-11-28
- 兰州大学唐瑜、吕少瑜 Adv. Mater.:有机亚稳室温磷光水凝胶 2026-02-21
- 南京理工傅佳骏/姚博文团队 Nat. Commun.:类神经、导电通路可重构的水凝胶基一体化电子电路用于人-机整合 2026-02-14
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 安徽理工大学张晓勇团队 JMCA:原位动态相互作用的仿贻贝坚韧自粘水凝胶用于开发智能传感器件 2025-01-11
