血液供应不足、过度炎症和氧化应激是缺血性疾病的主要诱因。现有文献通常利用基因转染或重组蛋白策略,促进缺血部位的血管生成,从而有效增加血流灌注。然而,过度炎症和氧化应激的微环境会减弱上述治疗效果,也存在较高的复发风险。为此,开发一种联合治疗策略,加速血管化同时正常化缺血微环境,这能够增强缺血治疗效果。作为一种气体信号分子,一氧化碳 (CO) 被证实具有多种生理作用,尤其是抗炎、抗氧化和刺激血管内皮细胞生长作用。基于此,研究人员推测CO是一种有前景的缺血治疗药物。受此启发,天津大学冯亚凯教授、郭锦棠教授和任相魁副教授首次将“控释CO”策略应用于严重肢体缺血治疗。
该工作通过血管内皮细胞粘附肽功能化的刺激响应载体封装 CO 释放分子(CORM-401),制备出用于递送CO的纳米粒(PR@CORM)。其可响应于缺血微环境中升高的ROS水平以控释CO,结果表明其能够有效正常化缺血微环境,但是促血管生成效果不太理想。因此,该工作将“CO疗法”与“基因治疗”巧妙结合,创新构建出CORM-401和促血管生成基因pZNF580共递送纳米系统(PR@CORM@ZNF),以协同挽救严重肢体缺血。
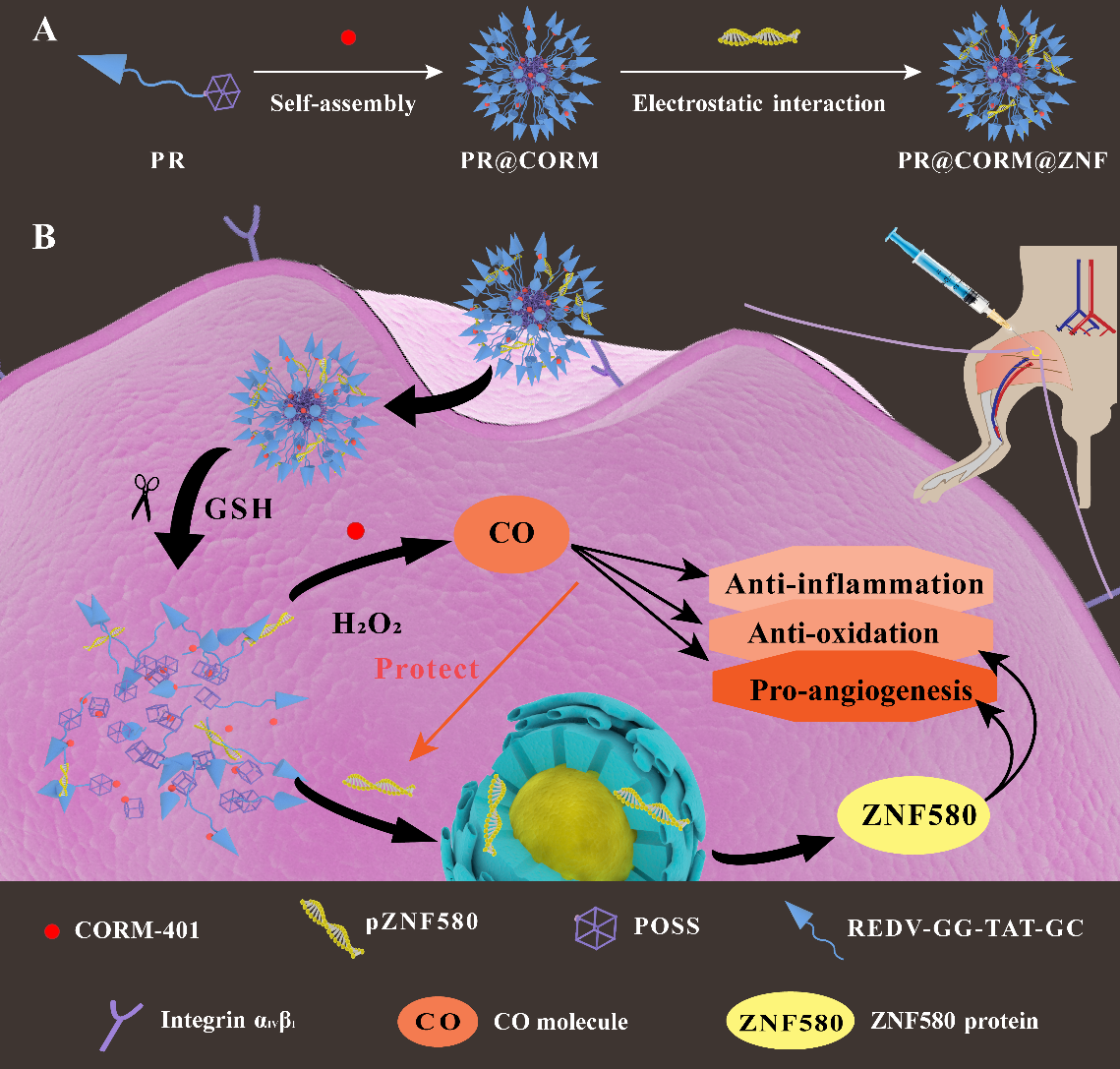
为了将CORM-401和pZNF580高效且有选择性地递送到血管内皮细胞中,该工作将内皮细胞靶向肽和细胞穿透肽(REDV-GG-TAT-GC)结合到POSS载体表面,进行精准化药物/基因递送。该载体可以通过亲水-疏水相互作用自组装形成核-壳纳米粒,即为共递送纳米系统。其中,亲水性REDV-GG-TAT-GC肽部分通过二硫键偶联至疏水性POSS,这使得共递送纳米系统可对缺血性血管内皮细胞内充足的谷胱甘肽刺激响应,从而断裂二硫键,这有利于治疗分子的有效释放。
细胞和动物实验结果表明,气体信号分子CO和 pZNF580可协同发挥作用,即PR@CORM@ZNF共递送系统同时实现了微环境正常化和加速血管生成,在严重肢体缺血的治疗中表现出突出优势。
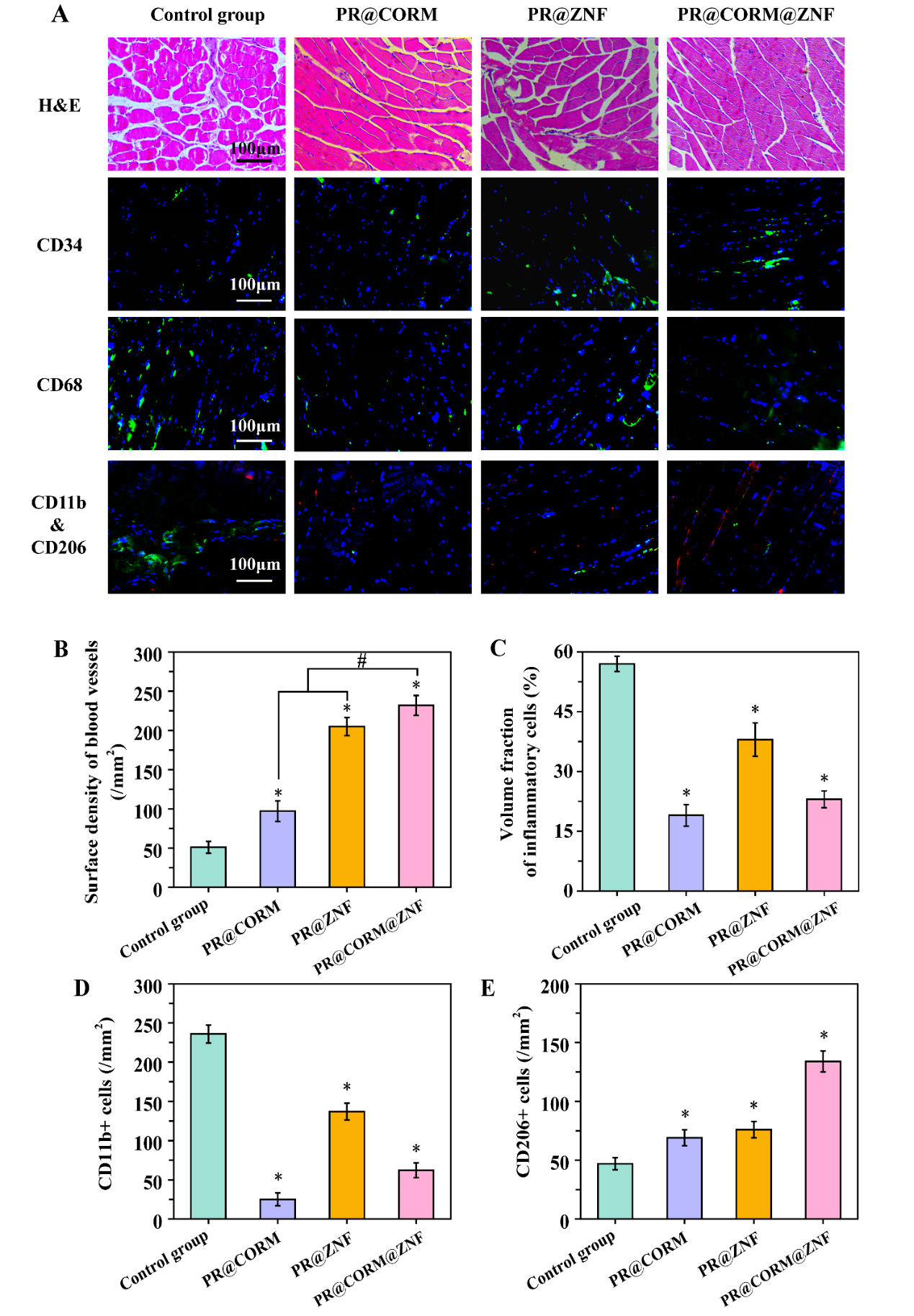
通过苏木精和伊红(H&E)染色、anti-CD34 抗体和anti-CD68 抗体、anti-CD11b(绿色)和anti-CD206(红色)抗体对缺血肌肉组织进行组织学分析的代表性图像(A),CD34阳性细胞数量化的血管表面密度(B),CD68阳性细胞数量化的炎症细胞体积分数(C),CD11b阳性细胞密度(M1型巨噬细胞)(D)和CD206阳性细胞密度(M2型巨噬细胞)(E)的统计结果。
此研究工作以标题为“A “controlled CO release” and “pro-angiogenic gene” dually engineered stimulus-responsive nanoplatform for collaborative ischemia therapy” 发表于国际著名期刊《Chemical Engineering Journal》(即时IF:12.88),天津大学博士生王小宇和高彬分别为本文的第一作者和共同第一作者,该研究受到国家自然科学基金(No. 51873149 and 51673145)和国家重点研发计划(Grant No. 2016YFC1100300)的支持。
原文链接 https://doi.org/10.1016/j.cej.2021.130430
- 暂无相关新闻
