生物体中的组织器官对于生命体的日常活动至关重要,其结构主要为蛋白质和水。水凝胶材料主要由高分子和水构成的,其结构特点与生物体中的组织器官非常相似,因此水凝胶材料被认为是组织器官修复过程中的潜在替代材料。然而水凝胶材料与生物体的组织器官不同,其材料的性能受到化学结构影响较大,在不改变化学组成的情况下调整水凝胶的机械性能,尤其是利用相同化学结构但材料力学性能不同的水凝胶材料来满足生物体中多样性的组织器官移植及修复等需求目前仍然是很难实现的。为了解决这个难题,本研究通过在一个系统中组合两性离子单体和酸性电解质单体,成功设计和合成了一系列具有可调节物理性能的水凝胶。
两性离子聚合物(PCDME)具有两性离子结构(同时含有带负电的-COO-基团和带正电的-R3N+基团),不仅表现出良好的生物相容性,而且在不同pH条件下可形成中性聚合物或带正电的电解质聚合物(图1 A)。但在前期工作中作者发现,当大量PCDME与PAMPS(强酸性电解质聚合物)结合使用时,尽管存在强酸PAMPS,PCDME还是保持中性性质。这是因为PCDME / PAMPS摩尔比(R)的值较大,PAMPS在体系中仅微量存在。因此作者设想,通过调节PCDME / PAMPS的真实摩尔比(true molar ratio R)就能够制备出不同性质的水凝胶。当R > 1时,PCDME为中性,PAMPS的存在会导致凝胶溶胀,形成互穿的网络和双网络结构的水凝胶。当R≈1时,阳离子PCDME和阴离子PAMPS浓度相等,形成PEC(Polyelectrolyte complex)水凝胶。当R <1时,PCDME的浓度太低而无法与整个PAMPS网络相互作用,导致凝胶体现为阴离子型聚电解质水凝胶(图1 B)。
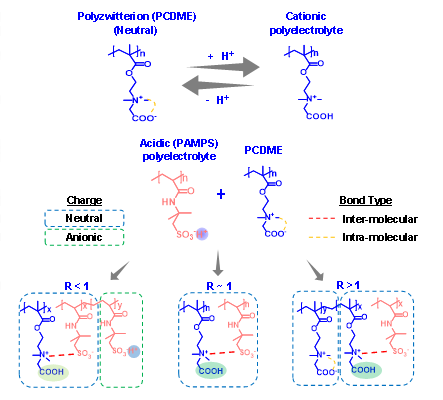
图 1.(A,B)相互作用的示意图,该相互作用使相同化合物可形成各种不同的水凝胶。
基于以上理论,本论文通过调节PCDME和PAMPS两种组分的摩尔比,利用两步互穿网络聚合的方法合成了一系列不同性质的水凝胶。

图2.通过调节PCDME / PAMPS摩尔比率R形成四个不同的水凝胶区域。这些不同类别的水凝胶由它们相应的溶胀率和杨氏模量来定义
根据上述结果,通过调节PCDME与PAMPS之间的摩尔比例(两性离子PCDME和酸性PAMPS),可开发出四种类型的水凝胶材料,即(PE(polyelectrolyte, R < 1, 1st network PAMPS膨胀,2nd network PCDM极少量,机械性能弱),PEC(polyelectrolyte complex, 1 < R < 3,1st network PAMPS收缩,2nd network PCDME接近等量,高强度,高韧性,可恢复性),IPN(interpenetrating network, 3 < R < 6.5,1st network PAMPS未完全膨胀,2nd network PCDME稍大量,低强度,低韧性,可恢复性),DN(double network, R > 6.5,1st network PAMPS完全膨胀,2nd network PCDME超大量,高强度,高韧性,不可恢复))并且通过拉伸实验(图3,4),以及循环测试实验(图5,6)等来解释在PEC,IPN和DN区域里不同内部结构导致的不同的机械强度,韧性以及能量耗损机理的影响加以解释。

图3.(A-D)四种不同水凝胶结构的应力-应变曲线:(A)聚电解质(PE)水凝胶,(B)聚电解质复合物(PEC)

图4. PEC,IPN和DN水凝胶机械性能的比较。(A)Ashby图,将拉伸过程中的断裂能与杨氏模量进行比较。通过改变R可以将断裂能和杨氏模量两个数量级进行调控。(B)和(C)分别代表了代表性的PEC和DN水凝胶与单网络的PCDME水凝胶的应力-应变曲线对比。
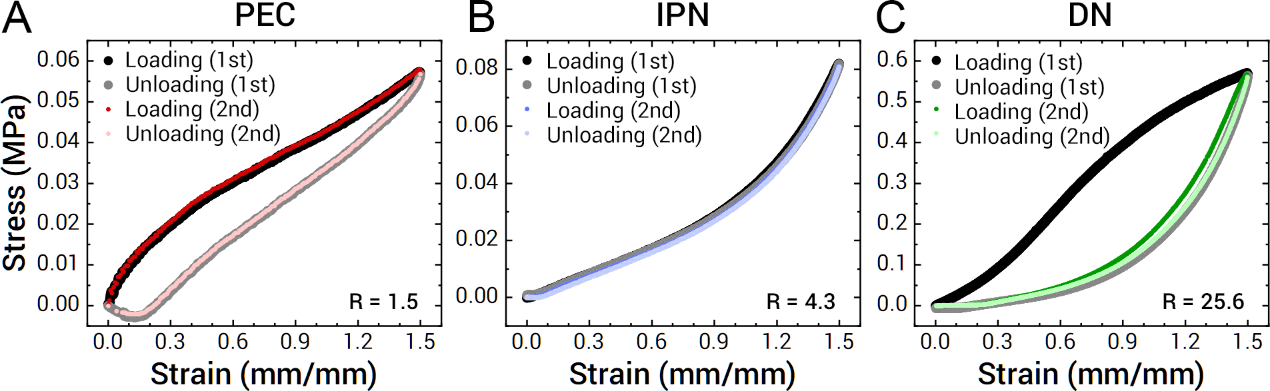
图5.循环测试以测量滞后现象和可恢复性。(A-C)使用1.5的应变对(A)PEC,(B)IPN和(C)
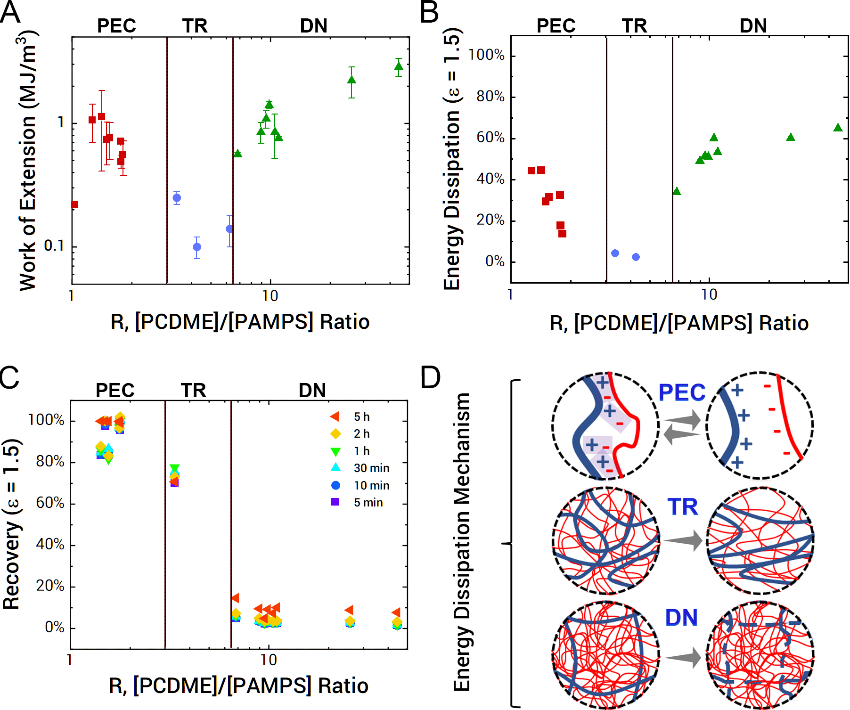
图6.拉伸测试和循环测试时的韧性比较。(A)拉伸过程中的断裂能,通过每个拉伸试验的应力与应变曲线面积进行积分得到的。(B)能量耗散率,通过将滞后能量除以ε = 1.5的断裂能来计算得到。
该体系仅使用一种单体组合(两性离子PCDME和酸性PAMPS),成功开发出四种不同类型的水凝胶,每种水凝胶都具有自己独特的机械和物理特性。这个方法简单并且高度可调控,有希望在组织工程领域得到广泛应用。
以上相关成果发表在ACS applied materials & interfaces (Yin H., King D.R., Sun T.L., et al. Polyzwitterions as a Versatile Building Block of Tough Hydrogels: From Polyelectrolyte Complex Gels to Double-Network Gels. [J]. ACS Appl. Mater. Interfaces, 2020。论文的第一作者为中国科学院大学温州研究院尹海燕,通讯作者为北海道大学的Daniel R. King助理教授, 龚剑萍教授。
原文链接:
1. https://doi.org/10.1039/c3tb20324g
2. “Aqueous gel”, Jian ping Gong, Takayuki Kurokawa, Haiyan Yin et al. WO2013172292 A1.
3. https://pubs.acs.org/doi/10.1021/acsami.0c15269
- UCLA 贺曦敏教授团队 Adv. Mater.:从“链段运动”入手 - 一种刷新各向同性纪录的超强韧PVA水凝胶 2026-02-26
- 宁波大学赵传壮 Macromolecules: 受挫相分离驱动的磷光可塑性水凝胶 2026-02-24
- 兰州大学唐瑜、吕少瑜 Adv. Mater.:有机亚稳室温磷光水凝胶 2026-02-21
- 天津大学刘文广教授/杨建海教授团队 Small:“溶剂极性诱导”策略制备兼具强韧、高阻尼、抗冻性的超分子两性离子聚合物有机凝胶 2025-05-27
- 北工商高海南课题组 Sci. China Mater.:盐度超敏感离子水凝胶用于盐度检测和智能液体阀门 2023-11-30
- 浙工大杨晋涛/郑司雨《Chem. Eng. J.》:具有多信号检测功能的智能聚两性离子门控膜 2023-08-05
- 中科院宁波材料所王荣团队 Mater. Horiz.:具有快速止血和耐强酸性的壳聚糖季铵盐/植酸止血粉末用于上消化道出血管理 2024-11-29
