结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,M.tb)感染引发的慢性传染性疾病,是单病原体致死人数最多的传染病(高于艾滋病),严重威胁人类健康。TB患者咳出的M.tb被健康人吸入后,首先被肺泡巨噬细胞吞噬并将M.tb运送到深部肺组织;被感染的肺泡巨噬细胞会招募大量免疫细胞到达感染部位,形成结核结节(Granuloma)。结核结节是TB特征性结构,由大量巨噬细胞紧密排列而成,其中心为“中央坏死区”,内含大量M.tb和与之对抗而死亡的巨噬细胞碎片。结核结节的致密结构能够有效隔离M.tb防止感染扩散。但是,当人体免疫力下降时,结核结节内的M.tb将大量活化和增殖,引发活动性结核。更重要的是,结核结节的致密结构严重限制了抗生素进入,致使临床上常规的多药联合治疗方案疗效差、疗程长、毒副作用大,从而导致患者依从性差及结核病的迁延不愈。因此,构建靶向结核结节的诊疗系统有望克服传统抗生素疗法的缺陷,成为结核病的新型诊疗方案。
中山大学附属第五医院廖玉辉、黄曦、单鸿教授团队联合香港科技大学唐本忠院士、赵征博士,开发了集新型聚集发光(AIE)材料、抗结核一线药物利福平(RIF)、双亲性胶束分子(DSPE-PEG2000)为一体的多功能纳米胶束。此纳米胶束表面的PEG链能够延长体内长循环,AIE材料发射强烈荧光实现结核结节的体内成像和追踪,AIE材料在激发光作用下产生大量ROS实现结核菌的光动力杀伤,纳米胶束包裹的RIF实现结核病的靶向协同化疗,最终实现结核病的精准诊疗(图1)
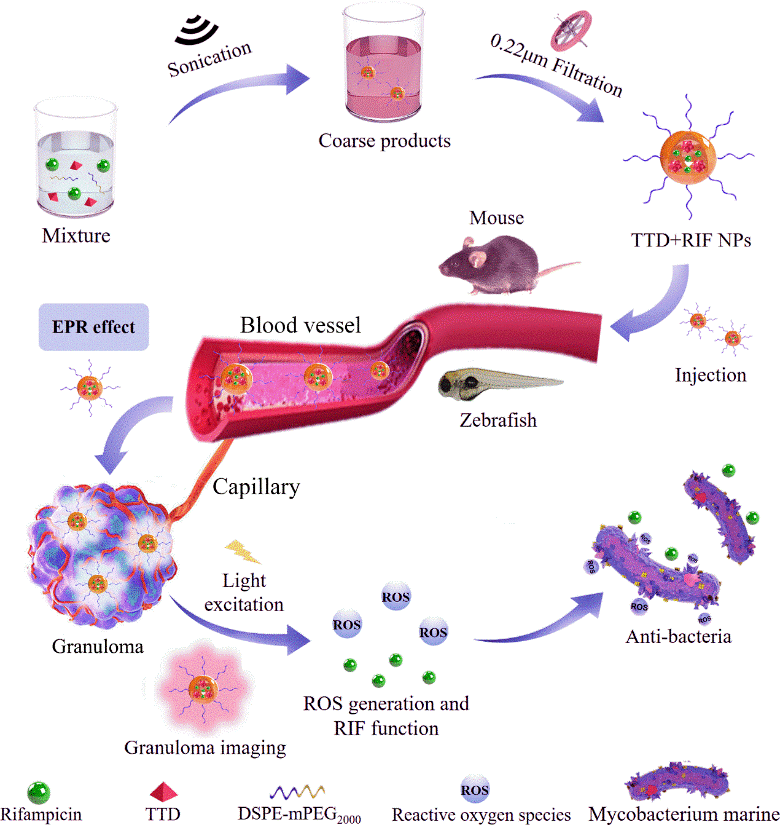
图1. 结核病精准诊疗原理图。Step 1:bottom-up方法合成多功能纳米胶束TTD+RIF NPs;Step 2:TTD+RIF NPs通过长循环和EPR效应实现结核结节靶向成像和追踪;Step 3:TTD+RIF NPs实现结核菌的光动力杀伤合并药物治疗。
该团队首先系统合成了新型AIE材料TTD(图2A),发现其具有发射强烈红色荧光特性(图2B)、聚集发光特性(图2C)和强烈的ROS产生特性。通过bottom-up方式合成TTD+RIF NPs后,可以得到粒径为~120 nm的球型纳米胶束TTD+RIF NPs(图2D),此NPs除了具备TTD的基本特性之外(图2E),还包裹了抗结核一线药物RIF(图F),从而实现结核菌的协同化疗。
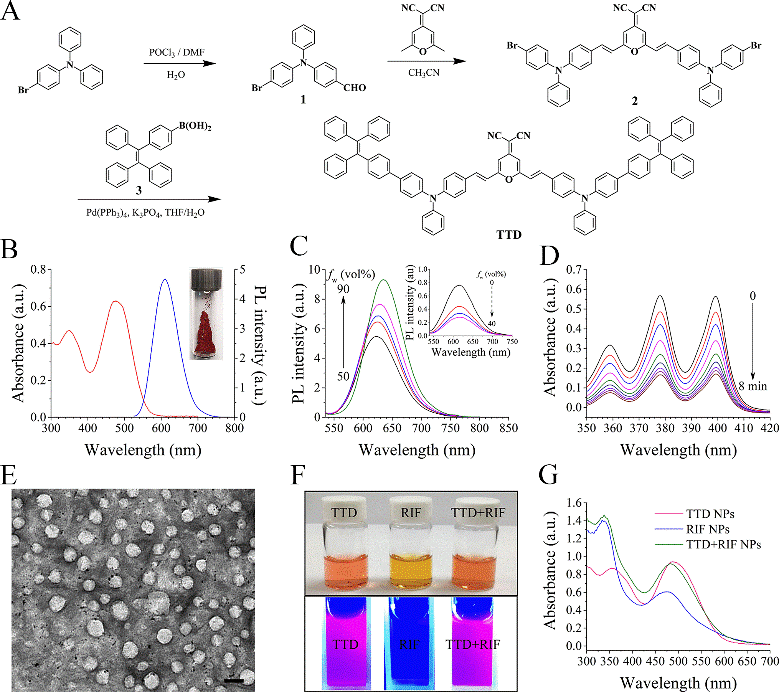
图2. 新型AIE材料TTD和多功能纳米胶束TTD+RIF NPs的合成和表征。
静脉注射此多功能纳米胶束TTD+RIF NPs到两种结节动物模型(图3)体内后,TTD+RIF NPs会借助其表面的PEG链逃避吞噬细胞的清除而实现体内长循环。通过EPR效应,TTD+RIF NPs靶向结节,实现结节的靶向成像(图4A,4C),并长期滞留结节部位,实现单个结节的长期靶向追踪(图4B)。
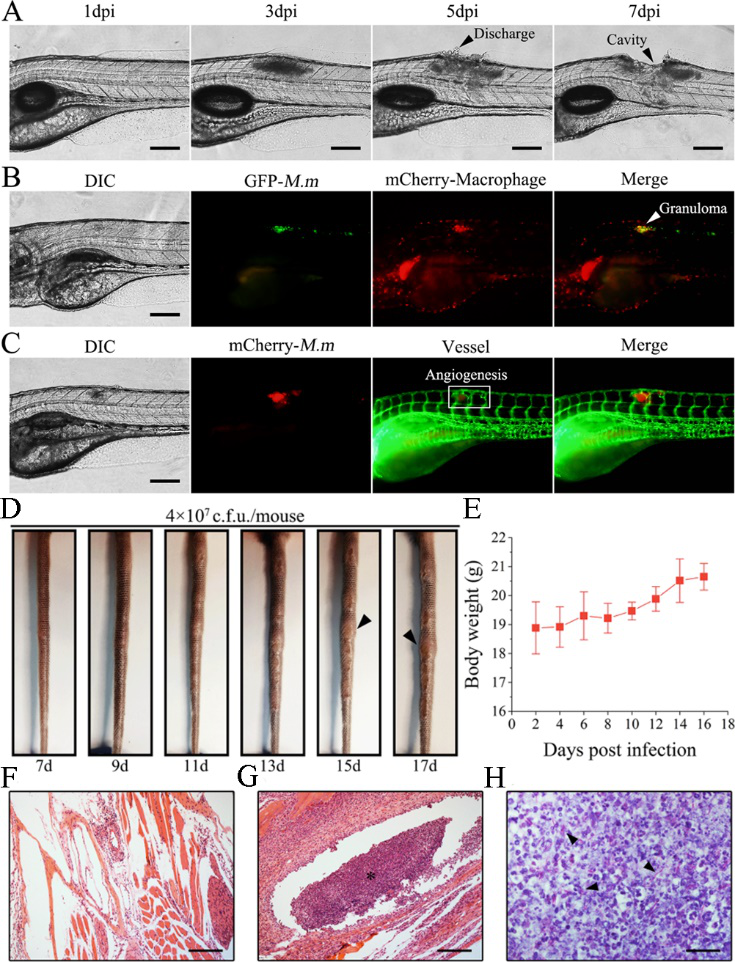
图3. (A-C) 海分枝杆菌感染所致斑马鱼神经管结节模型构建;(D-H) 海分枝杆菌感染所致小鼠尾部结节模型构建
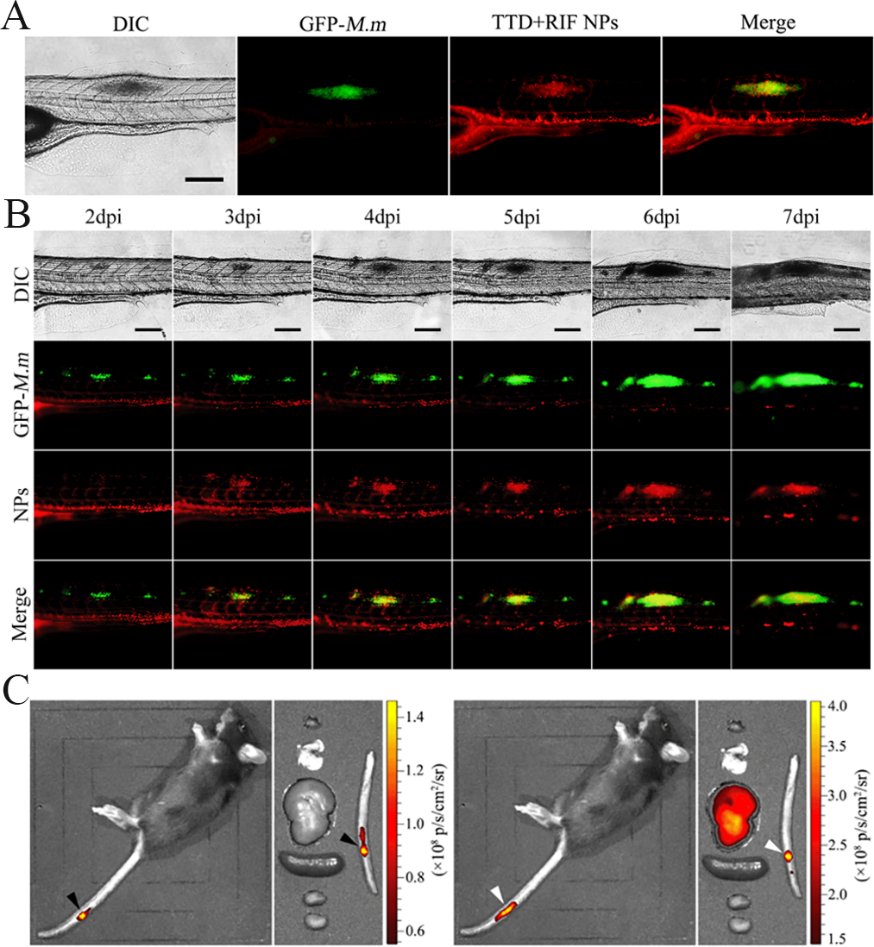
图4. (A) TTD+RIF NPs实现斑马鱼结节的靶向成像;(B) TTD+RIF NPs实现斑马鱼单个结节的靶向追踪;(A) TTD+RIF NPs实现小鼠尾部结节靶向成像。
对斑马鱼局部结节进行光照,相比于单纯RIF治疗组和PBS组,TTD+RIF NPs能够显著杀伤斑马鱼结节内部的海分枝杆菌(图5A,5B),斑马鱼生存率大大提高(图5C)。更重要的是,TTD+RIF NPs还能够显著杀伤对RIF完全耐药的耐药性结核杆菌(图5D,5F),预示着TTD+RIF NPs对治疗临床耐药性结核的巨大潜力。综上,基于聚集发光的多功能纳米胶束TTD+RIF NPs的纳米载药体系可以实现单个结核结节的靶向成像和追踪,能够显著杀伤结节内部的病原菌并对临床耐药菌有杀伤效果,为实现结核病精准诊疗提供新的思路,具有巨大的临床应用潜力。

图5. (A-C) TTD+RIF NPs实现斑马鱼结节部位海分枝杆菌的光动力杀伤合并药物治疗;(D-F) TTD+RIF NPs实现耐药结核菌的有效杀伤。
论文信息:Yuhui Liao?, Bin Li?, Zheng Zhao?, Yu Fu, Qingqin Tan, Xingyu Li, Wei Wang, Jialing Yin, Hong Shan*, Ben Zhong Tang*, Xi Huang*. Targeted Theranostics for Tuberculosis: A Rifampicin-Loaded Aggregation-Induced Emission Carrier for Granulomas-Tracking and Anti-Infection. ACS Nano. 10.1021/acsnano.0c00586 (SCI indexed, IF= 13.903; 工程技术一区)
论文链接:https://doi.org/10.1021/acsnano.0c00586
- 南林蔡旭敏、港中深唐本忠/汪文锦团队 AFM: 松香基天然电子受体构建TICT活性的双功能BioAIE材料 2025-07-22
- 唐本忠教授/林荣业教授团队、胡连瑞研究员 Nat. Commun.:变色龙聚集诱导发光分子在光、热调控下六重稳定态的可控转换 2025-07-11
- 香港中文大学(深圳)唐本忠院士/赵征教授团队《ACS Nano》:细胞膜靶向的聚集诱导发光分子用于神经追踪和损伤的可视化 2025-01-21
- 青岛大学魏登帅、孙勇等 ACS Nano综述:基于刺激响应性聚合物的纳米体系在癌症诊疗中的研究进展 2023-12-06
- 四川大学王云兵教授团队 Biomaterials:具有免疫逃逸功能的纳米载药涂层 2023-09-16
- 中科院高能所胡毅研究员和陈俊副研究员课题组在发展新型刺激响应性细胞靶向策略方面取得进展 2019-05-28
- 常州大学王建浩教授团队《Acta Biomater.》:药物储库型聚合物纳米胶束用于肿瘤长效治疗的研究成果 2025-07-08
