自组装高分子胶束作为多功能药物载体受到广泛关注。已有多种基于聚合物胶束的纳米给药系统被FDA批准或进入临床试验,但是它们的治疗效果并未达到预期。主要原因之一在于高分子自组装体固有的动态结构和不稳定性使其难以承受体内的高倍稀释及与血液成分的相互作用,进而导致药物的泄露和非特异性组织分布。尽管物理或化学交联能有效增强高分子自组装结构的稳定性,但同时会影响纳米系统的响应能力,降低药物在病灶的释放效率。因此,聚合物胶束的稳定性和响应性仍是目前亟需解决的矛盾问题。
近日,四川大学高分子科学与工程学院丁明明和谭鸿教授提出一种交联诱导再组装(CIRA)策略,利用界面点击交联驱动多嵌段聚合物发生微相分离,使聚合物胶束内核中的刺激敏感键迁移到胶束界面,从而同时提高聚合物载体的动力学和热力学稳定性以及还原响应性,实现灵敏的释药开关,解决高分子自组装体稳定和释放的矛盾问题(图1)。
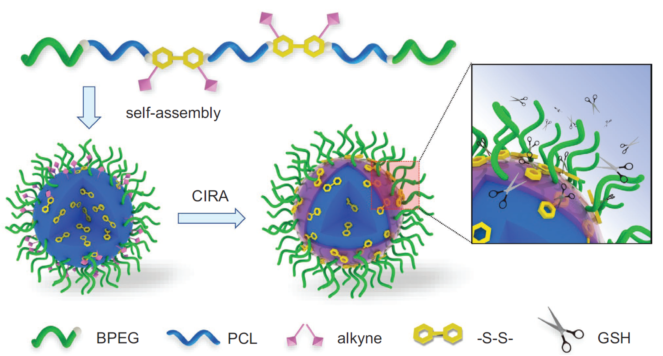
图1. 交联诱导再组装(CIRA)策略示意图
为了实现该策略,研究团队在前期工作(Biomaterials 2017, 145, 138-153)的基础之上设计并构筑可点击多嵌段聚氨酯(MPU)胶束,并使用一种可还原断裂的交联剂(SS-Az)进行界面点击交联。利用光散射、荧光光谱、二维核磁和傅里叶变换红外光谱等方法表征了自组装体的高级结构、稳定性和刺激响应性,阐明了CIRA驱动自组装体微相分离的机理(图2)。
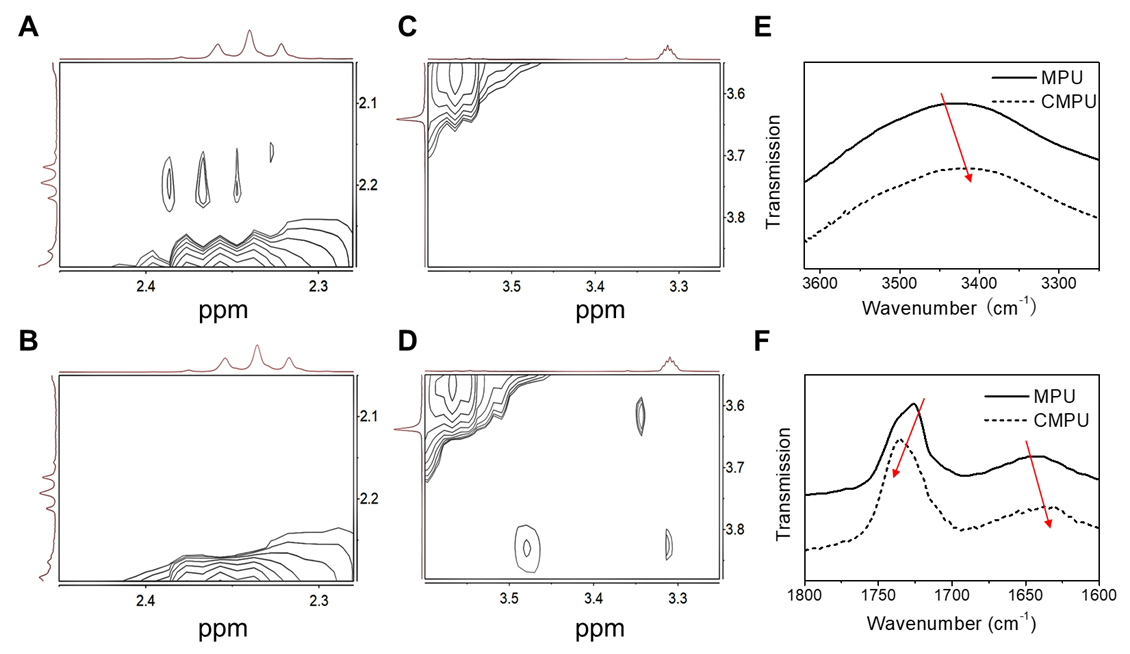
图2.交联驱动自组装体微相分离机制研究
进一步研究CIRA对于高分子纳米材料生物学性能的影响,以抗肿瘤应用为模型,发现CIRA功能化的胶束能够显著提高纳米系统的稳定性,实现灵敏的药物控释开关,从而延长药物循环时间,改善药物组织分布,在体内外实现良好的抗肿瘤效果(图3)。该工作为高分子自组装行为提供了新的理解,并为多功能纳米药物载体的设计提供新思路。

图3. CIRA功能化聚合物自组装体的细胞内药物传递和组织分布
以上相关成果发表于Advanced Science(DOI:10.1002/advs.201902701)。论文第一作者为四川大学硕士研究生杨瑞和郑毅,共同通讯作者为丁明明教授和谭鸿教授。该项研究工作得到国家自然科学基金(51873118,21474064,51203101)、国家杰出青年科学基金(51425305)和高分子国家重点实验室项目的资助。
论文连接: https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201902701
- 四川大学牛艳华教授/李光宪教授团队《Macromolecules》:弱有序聚离子液体嵌段共聚物的黏弹行为和离子传输特性 2025-12-27
- 华南理工大学王林格教授团队 Small:时间分辨小角 X 射线揭示聚合诱导自组装两嵌段共聚物胶束的生成机制 2025-09-09
- 天津大学潘莉教授团队 CEJ:具有双晶网络的乙烯-丙烯嵌段共聚物 - 高性能弹性体及HDPE/iPP共混物的升级回收 2025-07-20
- 香港中文大学(深圳)唐本忠团队 Nat. Commun.:均聚多肽自组装体系圆偏振室温磷光 2026-02-24
- 清华大学化学系许华平教授课题组招聘博士后 2026-01-14
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
