随着纳米技术的蓬勃发展,越来越多的纳米材料被用来构建药物载体以实现抗癌药物在体内的精准递送。相比于小分子药物,纳米药物通常具有较低的毒副作用,并且能够通过主动靶向或EPR效应更多地富集在肿瘤组织内。然而,在构建药物递送体系时,针对纳米材料尺寸的设计往往存在一个悖论。一般来说,小的纳米药物具有较强的肿瘤穿透能力,但同时也容易被肿瘤组织快速清除,使得药物累积不充分;大的纳米药物有助于延长药物在瘤内的滞留时间,但却难以渗透进入肿瘤组织内部。因此,为了同时实现纳米药物在肿瘤区域的长时间滞留和对深层肿瘤细胞的有效杀伤,构建一种“既能变大,又能变小”的智能响应纳米药物便显得尤为重要。
日前,东南大学生物科学与医学工程学院、生物电子学国家重点实验室的吴富根教授课题组发展了一种尺寸和结构可变的双重响应纳米药物。该纳米材料由细胞裂解肽melittin(蜂毒肽)、近红外光热分子cypate和具有肿瘤靶向能力的透明质酸(HA)高分子通过自组装形成。在pH 7.4环境中,该组装体为粒径约50 nm的纳米球,这有助于实现纳米药物在血液中的长循环。当特异性靶向至肿瘤区域时,这种纳米药物会在瘤内微酸性环境(~pH 6.8)的触发下从纳米球原位转变为纳米纤维,这大大延长了药物在肿瘤组织内的富集时间。此外,相关实验结果还证明了该纳米纤维的形成能够抑制癌细胞的迁移和侵袭,从而有效缓解了肿瘤向肺部的转移。进一步的,该课题组利用cypate等花菁类分子易发生光降解的特点,通过对肿瘤区域施加近红外光照使得纳米纤维重新变回为纳米球(~25 nm),实现了纳米结构的可逆转变。体内实验结果显示,近红外光照处理不仅极大增加了药物的肿瘤穿透深度,并且展现出良好的光热升温效果,确保了该纳米药物对原发肿瘤组织的彻底清除。
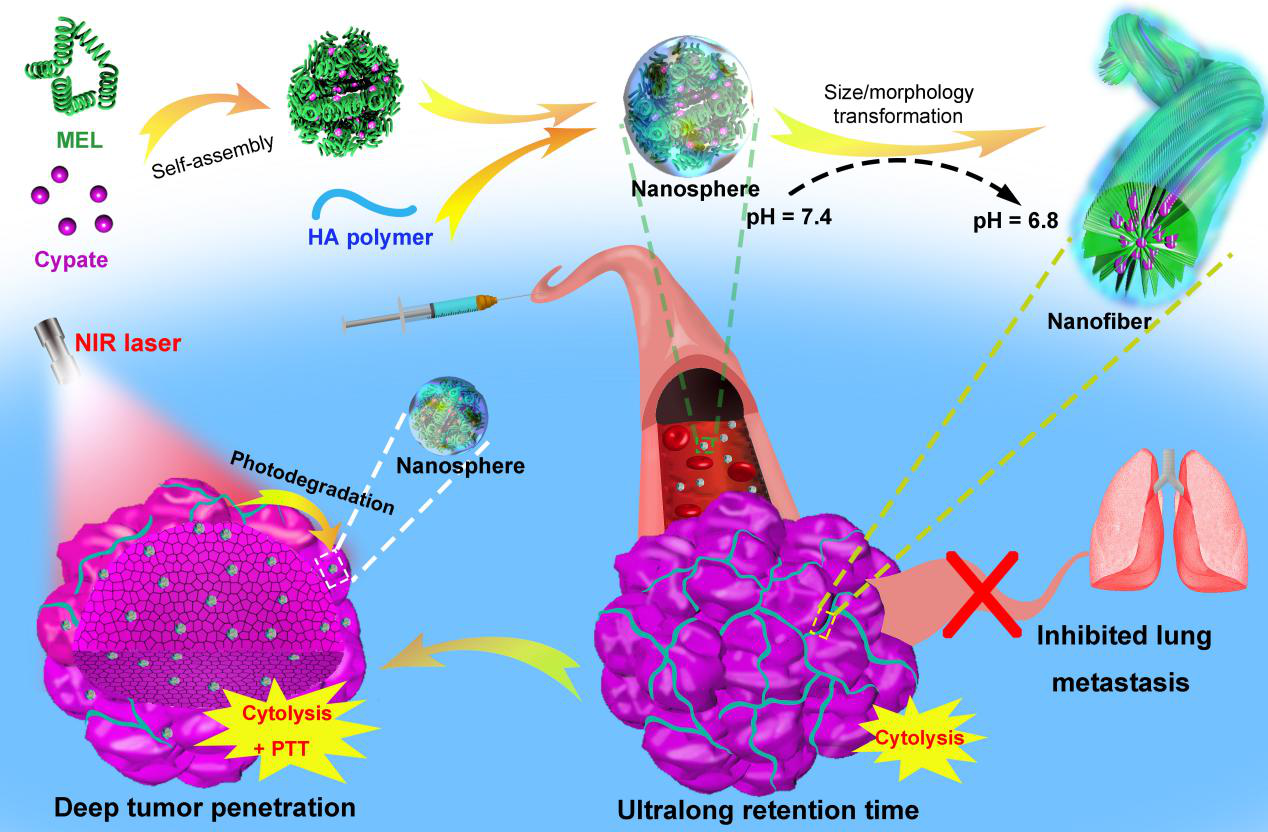
图1. 该纳米药物在肿瘤区域内实现双重响应结构转变的示意图。
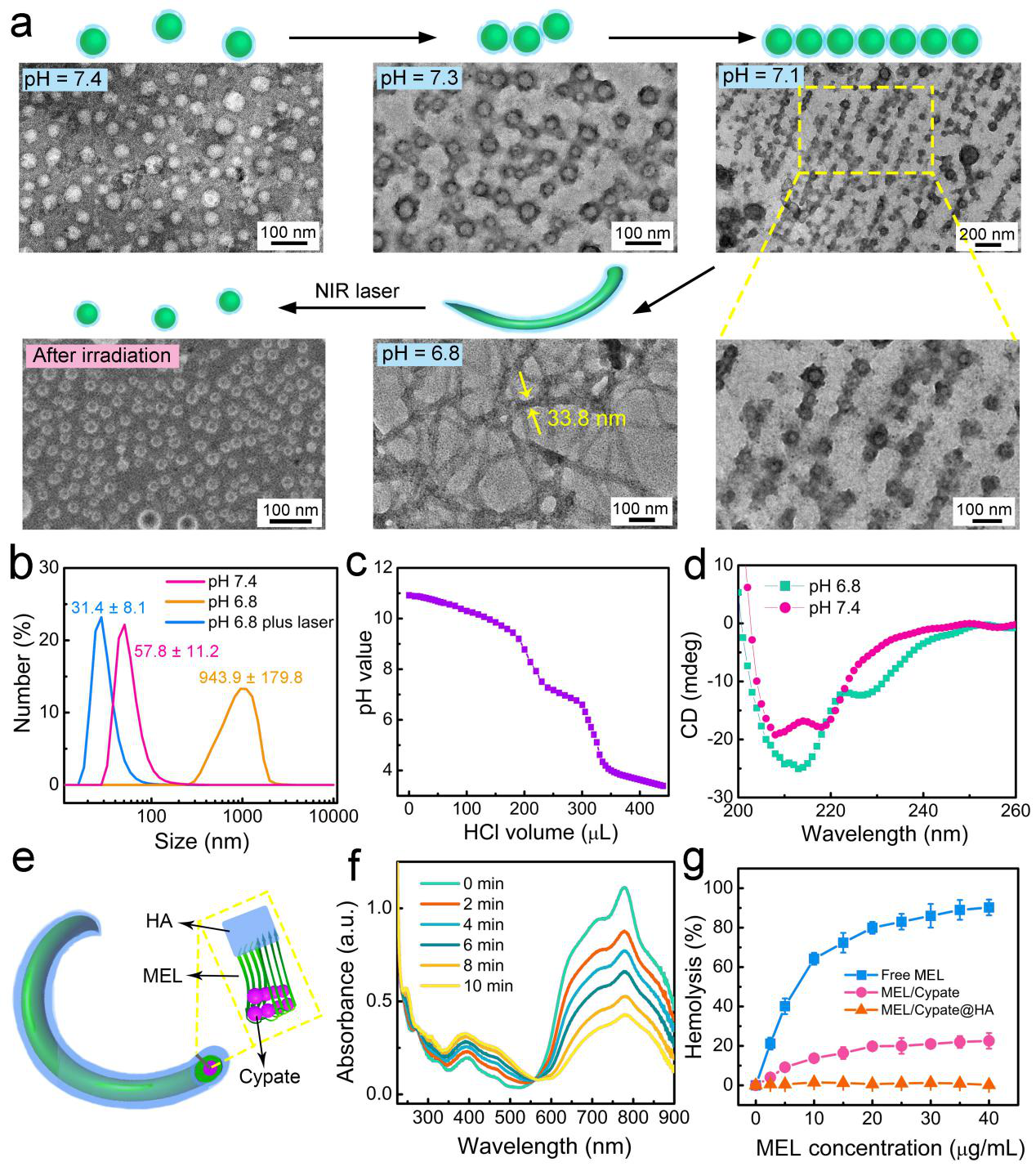
图2. 该纳米材料的相关表征结果。
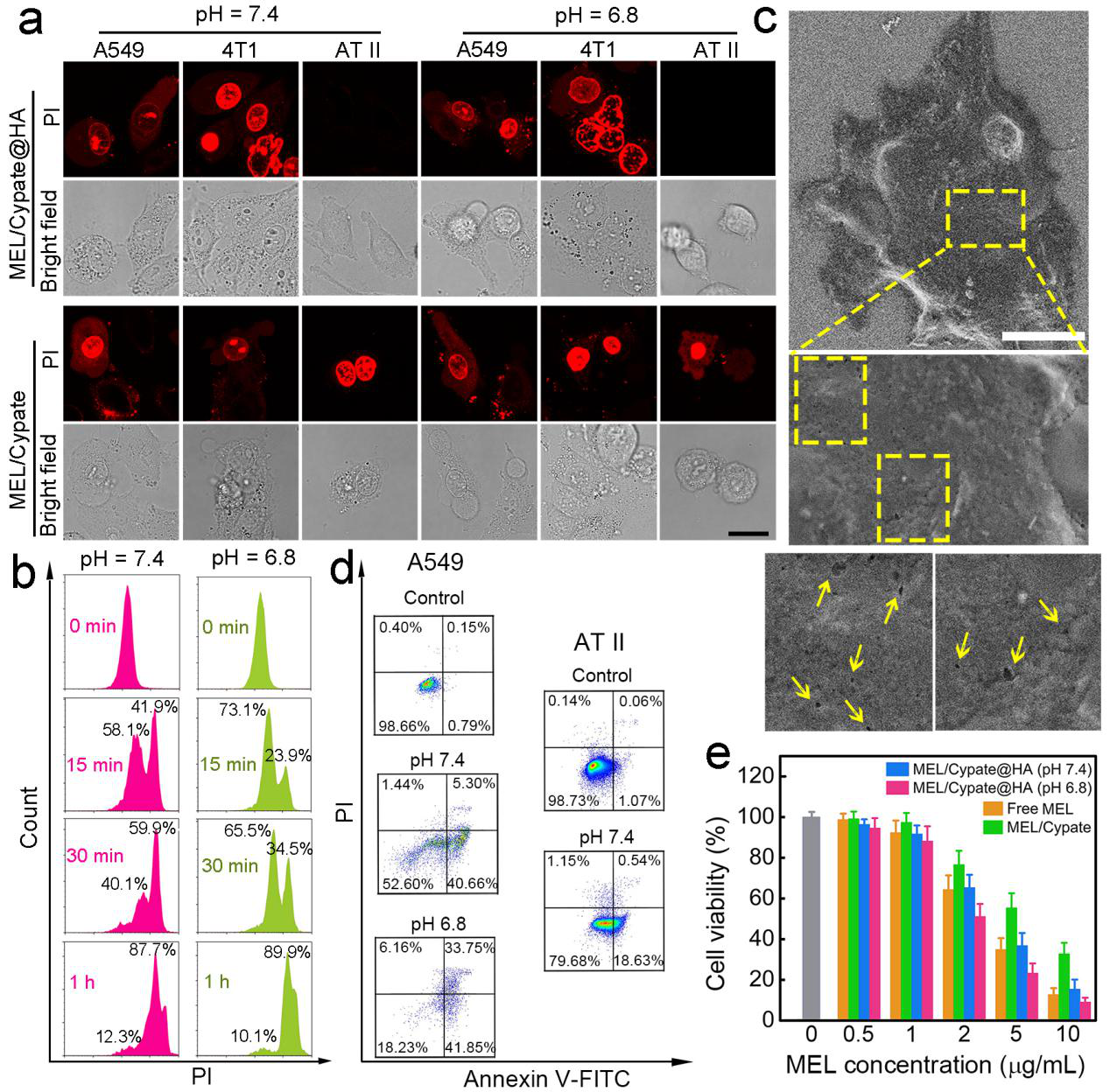
图3. 该纳米药物的体外细胞实验结果。

图4. 体外瘤球渗透深度的评价结果及该纳米药物对癌细胞迁移、侵袭等能力的影响。
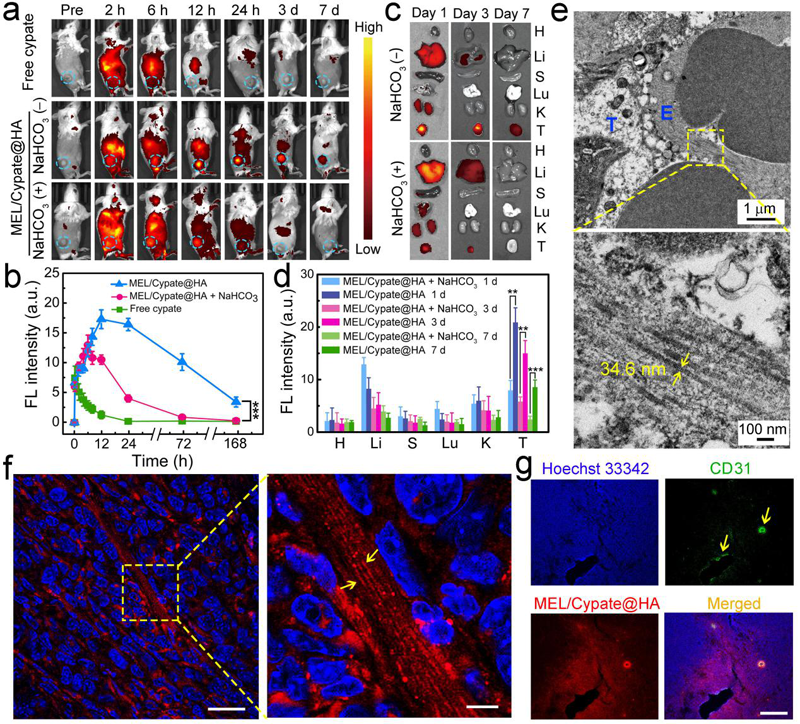
图5. 该纳米药物的体内分布结果及纳米纤维在瘤内的表征结果。
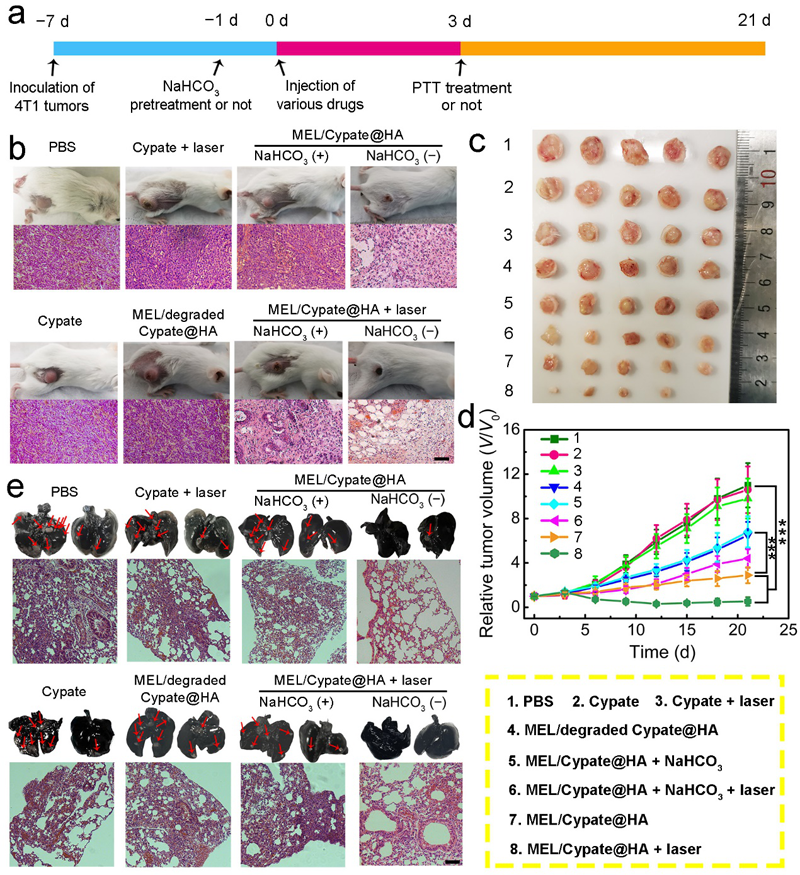
图6. 该纳米药物的体内抗癌效果评价。
相关研究成果以“Construction of Dually Responsive Nanotransformers with Nanosphere–Nanofiber–Nanosphere Transition for Overcoming the Size Paradox of Anticancer Nanodrugs”为题在线发表于近期的ACS Nano杂志上。东南大学的博士生贾浩然和祝雅璇为该论文的共同第一作者,东南大学的吴富根教授为该论文的通讯作者。
论文信息:Hao-Ran Jia#, Ya-Xuan Zhu#, Xiaoyang Liu, Guang-Yu Pan, Ge Gao, Wei Sun, Xiaodong Zhang, Yao-Wen Jiang, and Fu-Gen Wu*. Construction of Dually Responsive Nanotransformers with Nanosphere?Nanofiber?Nanosphere Transition for Overcoming the Size Paradox of Anticancer Nanodrugs. ACS Nano 2019, DOI: 10.1021/acsnano.9b05749.
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 香港中文大学(深圳)唐本忠团队 Nat. Commun.:均聚多肽自组装体系圆偏振室温磷光 2026-02-24
- 清华大学化学系许华平教授课题组招聘博士后 2026-01-14
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 苏州大学汪晓巧教授《Nat. Commun.》:仿生蛛丝再突破!湿纺技术制备高性能水凝胶纤维 - 兼具高强韧性与智能响应性 2025-12-03
