多重耐药性细菌引起的感染日益威胁着人类的健康。据估计,到2050年,在世界范围内细菌耐药性的持续上升将导致每年多达1000万人死亡,超过了癌症死亡的发生率。细菌对抗生素治疗的顽固抗性不仅来自浮游细菌的基因突变或结构转化,还来自生物被膜的形成,生物被膜为内部的细菌提供了相对稳定的生存环境,其中大量的胞外聚合物基质(EPS)具有屏障作用,阻碍抗生素的渗透,同时能帮助其抵抗宿主免疫系统的防御,使细菌感染的治疗复杂化。利用纳米材料的多功能性和灵活性提高药物在生物被膜内的局部有效浓度是解决这类问题的一个思路。

图1. 负载三氯生纳米胶囊PMPC-CS的制备
为了使纳米材料有效的停留在感染部位,进而高效清除细菌,通常需要其具有正电性的表面,正电性的纳米材料可通过静电相互作用吸附在细菌细胞膜上,释放的药物能够很快地被细菌摄取。但不利的一方面是,EPS占生物被膜总量的90%以上,传统的正电性纳米材料也会与生物被膜中大量的负电性EPS组分静电相互作用,这将阻碍纳米材料在生物被膜内部的深入渗透与扩散,从而影响治疗效果。
最近,刘阳研究员团队设计了一种具有核壳结构的纳米胶囊,以聚2-甲基丙烯酰氧乙基磷酸胆碱共聚物(PMPC)为壳层,壳聚糖纳米粒子(CS)为内核,随后负载抗菌剂用于生物被膜的治疗(如图1所示)。像聚2-甲基丙烯酰氧乙基磷酸胆碱这类两亲性离子聚合物,相对于PEG而言能够更强地结合水分子,形成水合层,抵抗非特异性蛋白质的吸附,是一种用于生物被膜渗透的理想材料。因此PMPC外衣赋予了纳米胶囊低EPS粘附的特性,帮助其穿透生物被膜的屏障,同时内核壳聚糖的正电性使纳米胶囊能够与细菌结合,最终达到药物的原位释放,这一复合特性使纳米载体同时实现了在生物被膜内部有效渗透与停留的最佳效果。

图2. (a) 纳米胶囊与EPS组分的作用情况;(b) 纳米胶囊与细菌S. aureus ATCC12600GFP的相互作用情况
然而,随着纳米胶囊中正电性链段与两亲性链段 (PAPM : PMPC) 比例的提高,纳米胶囊的对 EPS 组分的吸附也增加。这是由于随着聚合时 APM : MPC比例的提高,纳米胶囊的正电性增强,从而促进了纳米胶囊与EPS 组分的静电相互作用。另一方面,引入APM降低了纳米胶囊表面MPC的作用,直接减弱了纳米胶囊抗EPS吸附的能力。此外,分析实验结果发现,在 pH 7.4 时,P(MPC1-co-APM1)-CS和P(MPC1-co-APM4)-CS表现出相近的电位,但对 EPS 的吸附情况有较为明显的差异,这一现象暗示了纳米胶囊的表面性质直接影响了其在渗透过程中与生物被膜组分EPS的相互作用,从而在生物被膜中呈现出不同的渗透和积累效果。
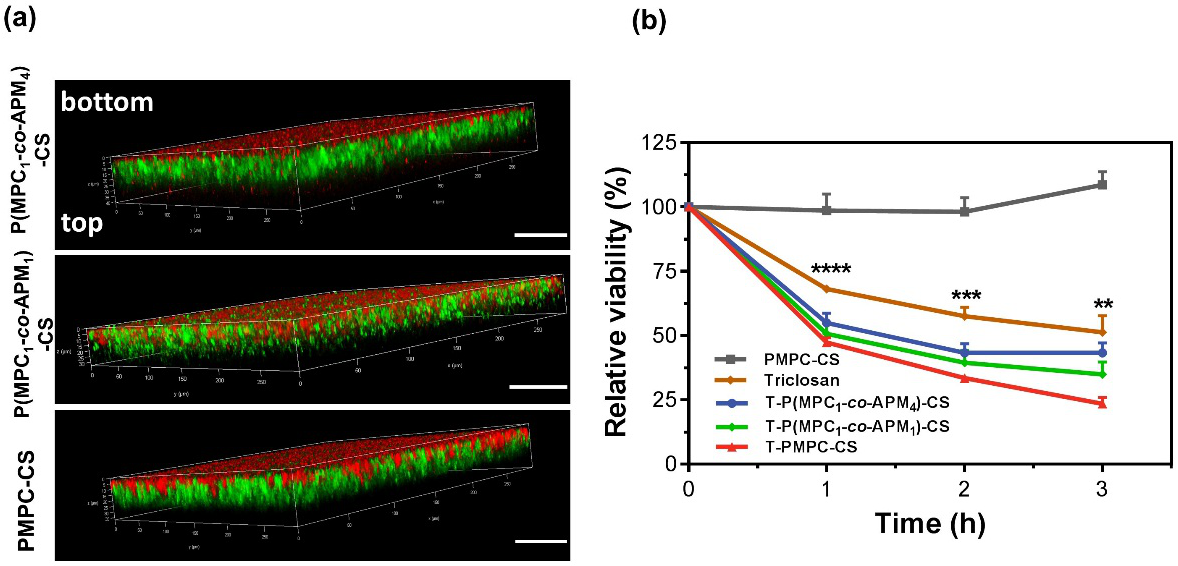
图3. (a) 纳米胶囊在生物被膜内的渗透与停留情况;(b) 纳米胶囊、游离三氯生及负载三氯生的纳米胶囊对生物被膜的抑制效果
此外,纳米载体利用内核壳聚糖在生物被膜酸性微环境下的溶胀效应,实现药物的酸响应释放。最终结果显示,与游离的抗菌剂相比,载药纳米胶囊表现出对耐药性细菌生物被膜更为有效的治疗效果,提高了抗菌剂的杀菌效率,克服了生物被膜的抗性。该团队构建的抗生物被膜感染的pH响应性多功能纳米递送系统,集成生物相容性、生物被膜组织的渗透、靶向递送药物等多种功能,调控载体表面特性将抗菌剂投递到感染部位的生物被膜内部,发挥高效抗菌作用,为治疗与细菌相关的感染提供了新的思路。
以上的研究成果发表在ACS Macro letters (ACS Macro Lett. 2019, 8, 651?657)上。论文第一作者为南开大学化学学院硕士生曹京京,通讯作者为刘阳研究员和史林启教授。
- 东华大学朱美芳教授、贾超副研究员等 AFM:抗菌、制冷多功能聚乙烯纤维防护材料 2026-01-06
- 华东理工刘润辉教授课题组 Nat. Commun.:双胍化多肽模拟物抗多药耐药ESKAPE与脑膜炎 2025-12-12
- 浙大张庆华教授团队 AFM:定制化多功能Janus织物 - 实现透气、抗菌与舒适个人热湿管理 2025-11-19
- 东北大学徐大可教授、李祥宇研究员团队 Angew:生物被膜框架衍生的结构自适应超滑防污防腐涂层 2025-04-14
- 北京化工大学王兴教授团队《ACS Nano》:聚(D-氨基酸)纳米粒子通过干扰葡萄球菌肽聚糖合成介导生物被膜瓦解 2024-03-13
- 北京化工大学王兴教授团队 ACS AMI:GSH/pH级联响应纳米粒子通过协同的光和化学疗法消除耐甲氧西林金黄色葡萄球菌生物被膜 2024-01-29
- 江南大学付少海/王冬团队 Small:原位矿化生成的双网络结构壳聚糖复合气凝胶用于替代石油基保温材料 2025-10-27
