许多生物材料和人工合成材料中都含有大量的水,例如生物器官和水凝胶。基于含水材料的应用近年来取得了显著的发展,例如器官修复,伤口愈合,药物传递等生物医学应用,以及可用于收集能量的人工植入芯片,用于脊椎损伤患者重新恢复运动功能的神经信号模拟和激励设备,和新型可穿戴传感器、驱动器等。
能够整合性质各异的含水材料,比如水凝胶和生物器官,是实现以上这些应用的关键因素。然而,含水材料之间的粘附一般非常弱,其粘接能往往在1 J/m2左右。相比之下,一般水凝胶和生物器官的断裂能有 100 J/m2,人体皮肤,软骨,韧带,以及韧性水凝胶可以达到 1000 J/m2。如何有效粘接各类含水材料,使其粘接能达到材料的断裂能仍是一个巨大的挑战。
以两块水凝胶之间的粘附为例。水凝胶中的水含量往往在 85 % 质量分数以上。当两块水凝胶贴在一起并形成界面时,水分子占据了界面上的大部分空间,而水凝胶中的高分子链只在界面上稀疏地分布。由于水分子几乎无法承受剪切力,从界面处剥离两块水凝胶所需要的能量释放率十分微弱,而稀疏的高分子链更是对粘接能几乎没有贡献。由此可见,含水材料间极弱的粘附是材料本身的固有属性,极大地限制了含水材料的广泛应用。
现存的含水材料的粘接方法都存在以下的一些问题:1. 粘接能远远低于断裂能;2. 生物毒性;3. 机械性能差;4. 需要引入特殊官能团。例如,我们生活中广泛使用的“万能胶”,氰基丙烯酸酯 (cyanoacrylate),可以实现强粘接,但其生物性能和机械性能均与器官和水凝胶不相容。近年来发展的一些其他方法需要水凝胶有特定官能团的,有很大的局限性。
受到手术伤口缝合线的启发,哈佛大学锁志刚教授课题组首次提出含水材料的“分子缝合”技术。研究人员把聚合物溶液作为胶水涂在两层含水材料的界面处,溶液中的高分子链从界面处扩散进入含水材料的聚合物网络后,受到特定的触发条件,如pH,温度,光,盐等,会交联形成一层新的网络。这层新的网络与原本的两层含水材料的网络形成拓扑缠结,从而产生强韧的粘接。也就是说,在分子层面上,这一层新的聚合物网络如同“缝合线”一般,将原先的两片含水材料的网络在分子尺度上“缝”在了一起。这个粘接方法称为拓扑粘接法。
pH-触发拓扑粘接实例
以pH触发的拓扑粘接为例。壳聚糖(chitosan)的pKa为6.5。当外部溶液的pH低于6.5时,壳聚糖呈溶解状态(图1a);高于6.5时,壳聚糖的分子链直接形成氢键并可以形成聚合物网络(图1b)。研究人员将pH = 5的壳聚糖溶液像胶水一样涂抹在两层pH = 7 的水凝胶之间(图1c)。经过几小时的静置,壳聚糖链扩散进入水凝胶中,在pH = 7的环境中通过氢键交联形成第三层网络,与原先的含水材料中的聚合物网络形成拓扑缠结从而达到强粘接(图1d)。整个样品(两层水凝胶与之间的壳聚糖网络)仍然保持高度透明(图2)。
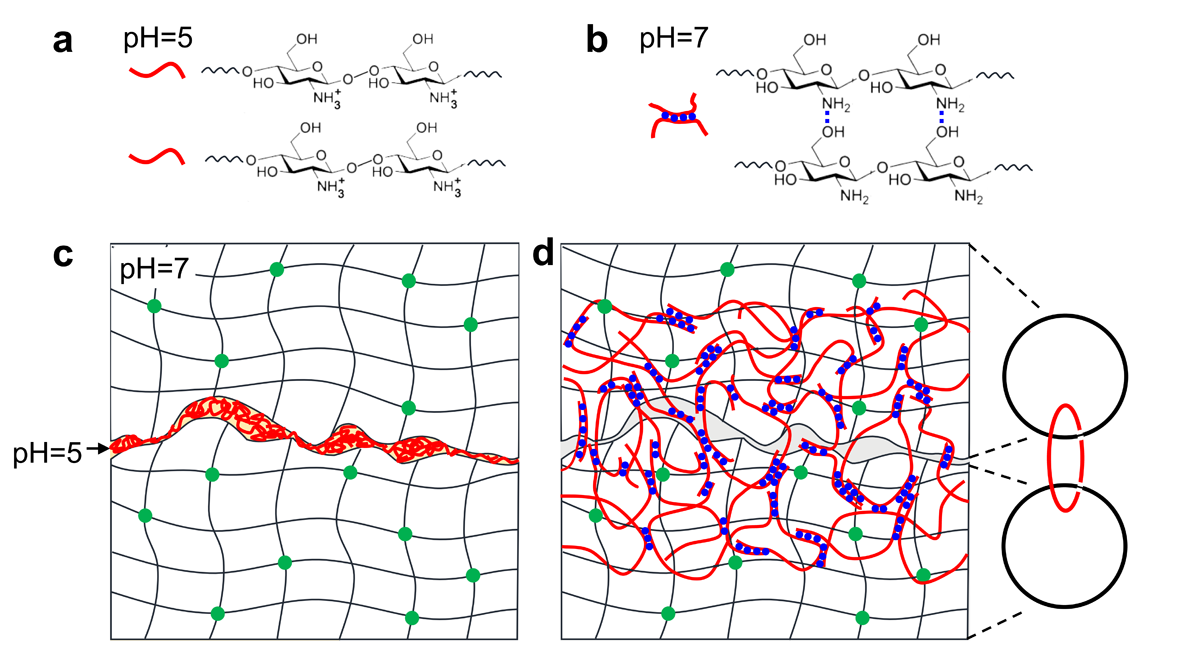
图1. pH-触发拓扑粘接。

图2. 拓扑粘接形成的透明样品
拓扑粘接法适用于任何含水材料
由于这种pH引发的拓扑粘接不需要来自于含水材料的任何特定官能团,该方法可以在几乎任意含水材料之间产生强韧的粘接。研究人员合成了不同的常见水凝胶,并用壳聚糖来验证这一普适的强粘接。在所有情况下,相同两层水凝胶之间的粘接能都几乎达到了水凝胶本身的断裂能(图3a)。此外,该方法还可实现水凝胶与生物组织间的强粘接(图3b)。由于壳聚糖为生物多糖,此种情况下的拓扑粘接法具体良好的生物相容性。

图3. 拓扑粘接法可对任意含水材料产生强粘接
拓扑粘接法适用于全范围的pH环境
人体器官都有一个特定的体液酸碱环境。绝大多数器官的体液环境保持pH接近中性,比如心脏,皮肤等;一些器官的体液环境非常酸,比如在胃的内部,胃酸的pH在2左右;另一些器官的体液环境偏碱性,比如胰腺分泌液的pH在8左右。拓扑粘接法适用于全范围pH就显得十分必要。研究人员选取了不同pKa值的四种分子链:壳聚糖(chitosan),纤维素(cellulous),聚(4-氨基苯乙烯)(Poly(4-aminostyrene)),海藻酸钠(alginate)。这些分子链交联成网络所需的pH范围各不相同,把这些pH范围组合在一起就覆盖了全范围的pH(图4a),也就实现了在全范围pH的强韧的拓扑粘接(图4b-e)。
值得一提的是,强酸或强碱环境下的强韧粘接一直以来都是一个难题。例如,在人体胃液的强酸条件下,即便是常用的“万能胶”,cyanoacrylate,也会失效。基于拓扑粘接法,研究人员只需选用合适的“缝合聚合物”形成网络,就可以轻松地实现极端pH环境下的强粘接。

图4. 拓扑粘接法适用于全范围的pH环境
拓扑粘接法可实现pH触发的可逆脱粘
pH触发的拓扑粘接还具有可逆性。以壳聚糖为例,只需要调节界面处的pH值,就可以形成或打开相应的壳聚糖网络(图5)。研究人员在两层用壳聚糖粘接好的水凝胶的下层悬挂一重物,并分别在两层水凝胶的界面处滴加蒸馏水(视频1a)和盐酸(视频1b)。滴加蒸馏水的界面完好无损,而滴加稀盐酸的界面逐渐脱粘,直到上下两层水凝胶完全分离。

图5. pH触发的拓扑粘接的可逆性
视频1a. 在已粘接的两层水凝胶界面处滴加蒸馏水。
视频1b. 在已粘接的两层水凝胶界面处滴加稀盐酸。
拓扑粘接法的脱粘机理
基于拓扑粘接法的界面脱粘存在两种可能的模式(图6a)。如果“缝合网络”强于含水材料的网络,界面脱粘是由于含水材料网络的断裂导致,实验测得的粘接能应与含水材料本身的断裂能相同;如果“缝合网络”弱于含水材料的网络,界面脱粘则是由于“缝合网络”的断裂导致,测得的粘接能应小于含水材料的断裂能。
研究人员对比了用壳聚糖粘接的两块聚丙烯酰胺(PAAM)水凝胶的粘接能和聚丙烯酰胺水凝胶本身的断裂能(图6b 黑色与蓝色)。由于缺少显著的能量耗散机制,实验测得的粘接能和断裂能均不显著依赖于裂纹扩展速度。然而, 测得的粘接能在任何速度下都低于凝胶本身的断裂能。这表明了界面脱粘是由于“缝合网络”的断裂所导致。值得注意的是,拓扑粘接法产生的粘接能即使在500 nm/s的裂纹速度下依然高达60 J/m2,与共价键网络的断裂能在同一量级。这一结果说明了即使是通过氢键交联的“缝合网络”也具有很高的稳定性和机械强度,其网络强度可达到共价交联的网络强度。
此外,用壳聚糖粘接两块韧性水凝胶,海藻酸钙-聚丙烯酰胺(Alg-PAAM),粘接能在高脱粘速度下可以很容易地达到1000 J/m2 以上,这表明了基于壳聚糖的“缝合网络”的自身强度已经足够触发韧性水凝胶内部的能量耗散机制,从而显著提升粘接能。另一方面,在低脱粘速度下,由于海藻酸钙-聚丙烯酰胺缺失耗散机制,其粘接能将接近于两块单网络聚丙烯酰胺的粘接能,粘接能并没有随着使用韧性水凝胶而得到提高。
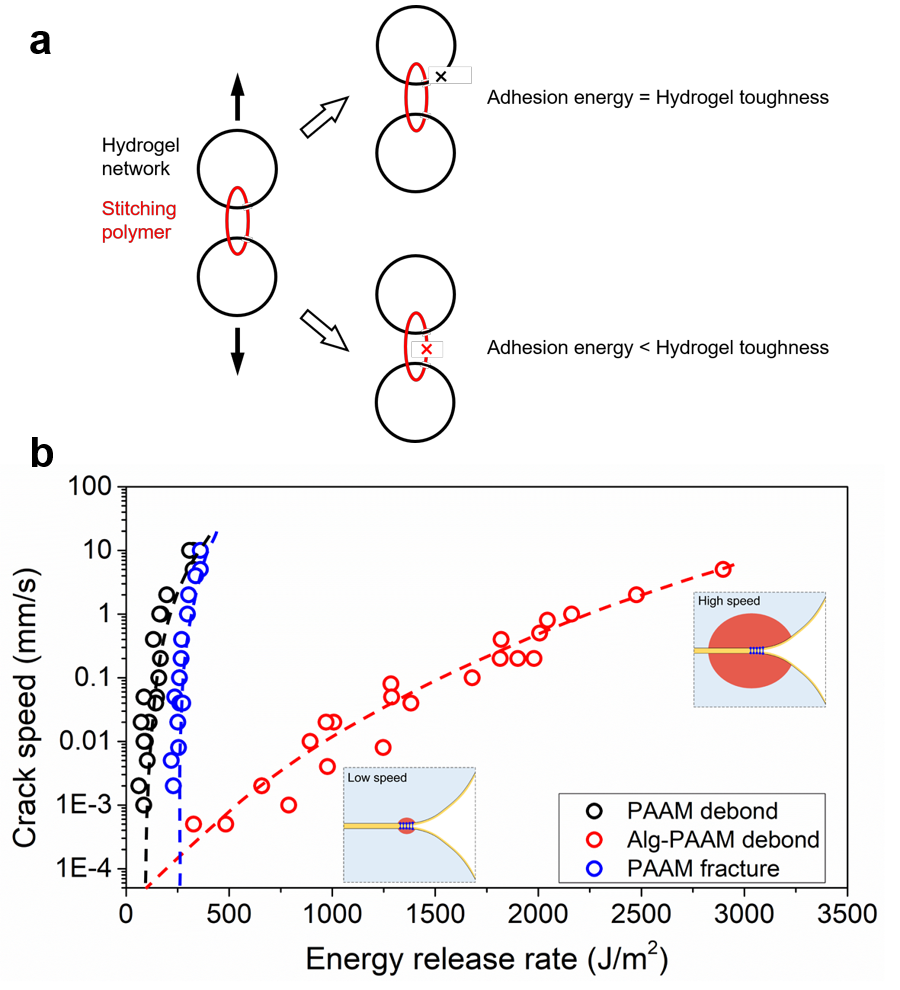
图6. 慢速断裂实验研究拓扑粘接法的脱粘机理
拓扑粘结法作为新的粘接机制可以满足不同临床粘接需要。“分子缝合”不但减轻了传统缝合线给患者带来的不适或者疼痛,还可以通过精准的分子设计达到不同的粘接效果,例如永久粘接,暂时粘接,或者人为选择脱粘。当水凝胶作为器官修复物时,永久粘接更被需要;当水凝胶作为伤口敷料时,在伤口愈合后,水凝胶需要降解吸收或者人为脱粘。基于这些需求,“分子缝合”有潜力在更大的领域中被推广使用。例如通过酸碱,热,光,或者特定化学物等实现在多种复杂环境和极端环境中的粘接。
该研究工作发表在Advanced Materials (2018, 1800671)。杨加伟博士(哈佛大学博士)和白若冰博士(哈佛大学博士)为论文共同第一作者,哈佛大学、美国工程院院士锁志刚教授为论文通讯作者。
论文信息与链接
Jiawei Yang, Ruobing Bai, Zhigang Suo, Topological Adhesion of Wet Materials
J. Yang, R. Bai, Z. Suo, Adv. Mater. 2018, 1800671.
- 兰州大学唐瑜、吕少瑜 Adv. Mater.:有机亚稳室温磷光水凝胶 2026-02-21
- 南京理工傅佳骏/姚博文团队 Nat. Commun.:类神经、导电通路可重构的水凝胶基一体化电子电路用于人-机整合 2026-02-14
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
