复旦大学丁建东教授课题组《Bioact. Mater.》:准三维细胞研究平台的研制及细胞行为研究
2022-01-27 来源:中国聚合物网 点击次
关键词:生物材料

图1. 本研究的基本思路。(A) 细胞响应准三维力学刺激的示意图。(B) 具有拓扑微结构的PDMS膜的制造及组装。 该微流控芯片地制备存在诸多难点:首先,需要进行两次对准;其次,在对准之后还要立即进行等离子体键合以免失活;此外,硅晶片上的微图案通常难以观察清楚,增加了对准难度。为了解决这些问题,研究人员设计并组装了一种新型的芯片快速对准仪(图2)。凭借该对准仪的预对准程序和有效观察的优点,在等离子表面处理后可在1分钟内即可完成对准和键合。


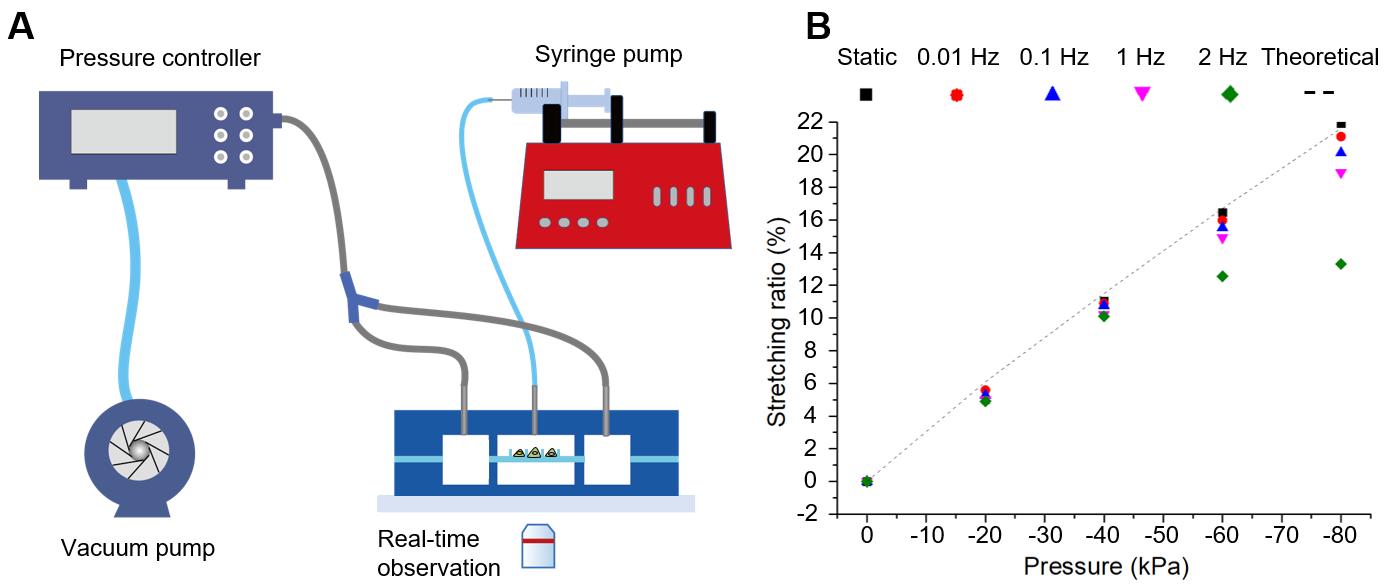
图4 (A) 微流控拉伸系统。(B) 不同拉伸频率下拉伸率与压力的关系。理论结果代表来自有限元分析的静态拉伸率。
研究人员对细胞的“类三维”状态进行详细表征—使用共聚焦显微镜获取原始细胞的三维数据、通过三维重构来数字化显示细胞形态,并使用球形度来估计细胞形状。图5A展示了通过共聚焦显微镜获得的荧光转染活细胞状态。研究人员发现拓扑微结构可以显著地改变细胞形态:在S中,细胞受到严格约束,因此细胞表面粗糙(低球形度);在L中,细胞松散地黏附在微井的底部和侧壁上,呈铺展形态(低球形度);而在M中,细胞适度黏附于微井,因此细胞趋于圆形(高球形度);F上的细胞是四种基板中最平坦的(球形度最低)。球度是用三维重建的数字信息计算的。细胞球度的统计结果分别为0.54(S)、0.65(M)、0.59(L)和0.50(F)。

图5. 微柱中 RFP-hMSC 细胞的三维表征。(A) 三种微井阵列 (S、M 和 L)中和平面(F)上的细胞形态。从左到右的四行表示四种基板的示意图、共聚焦显微镜典型结果、三维重构结果、准三维细胞黏附示意图。在共聚焦图片中,红色表示用RFP标记的活细胞,明场表示微柱阵列。(B) 细胞的球度 (n≥80)。 图 6A显示了在循环拉伸(1 Hz,10%)期间,RFP-hMSC细胞的扩散和取向发生了显著变化。图 6B 则显示了细胞铺展和取向随时间变化的统计数据。在拉伸的0-2小时内,细胞在S、M和L阵列中的铺展普遍降低(减少5-8%),而在平面(F)上不明显(减少~1%)。可见,一些细胞选择了收缩成圆形并黏附在微柱的侧壁上以避免物理扰动。在2-10小时内,细胞的铺展达到稳态,铺展率分别为39% (S)、58% (M)、53% (L)和76% (F)。

图6. RFP-hMSC细胞在循环拉伸过程中的铺展和取向。 (A)循环拉伸后微井阵列中细胞的显微照片。底部的双箭头表示拉伸方向。荧光模式检测带有RFP(红色荧光)标记的活细胞,相差模式观察微柱阵列;图中所显示的是合并的图像。(B)细胞的表观铺展率和序参量随拉伸时间变化的结果,其中的红线仅用于视觉引导。(C) 循环拉伸的二维或准三维材料微环境中细胞状态的示意图。 拉伸促使细胞迁移发生根本性变化。从图7(上部)显示的单细胞迁移轨迹可以看出,拉伸显著改变了细胞迁移模式。可见在拉伸过程中,细胞感觉到强烈的力学干扰,而为了避免扰动,细胞选择在拉伸的垂直方向上迁移。此外,研究人员用轮廓迁移速度和均方位移 (MSD) 量化了细胞迁移。轮廓迁移速度由迁移长度 ( l ) 除以迁移时间 ( t )得出(详见图7左上角示意图),
 (1)
(1)
其中D是扩散系数。

图7. 循环拉伸 (St.) 和非拉伸 (N.St.) 下单个细胞的跟踪路径。图中显示了每个基板的30个细胞轨迹。MSD是根据每1小时迁移轨迹的端到端距离计算得出的。MSD的X和Y分量用于计算迁移的方向性。
为了清楚地表征细胞与材料之间的相互联系,研究人员将hMSC细胞培养在二维(在平面PDMS上)、准三维(在PDMS微井中)和三维(在 Matrigel)微环境中。固定染色后,在共聚焦显微镜下逐层扫描细胞。结果如图8所示:黏着斑蛋白(vinculin)和微丝(F-actin)在所有维度中都很显著,这说明细胞与材料之间存在明显的黏附位点。其中研究人员发现,在三维微环境中的黏着斑蛋白的荧光强度相对较弱,这可能是由于细胞与软水凝胶的黏附较弱引起的。
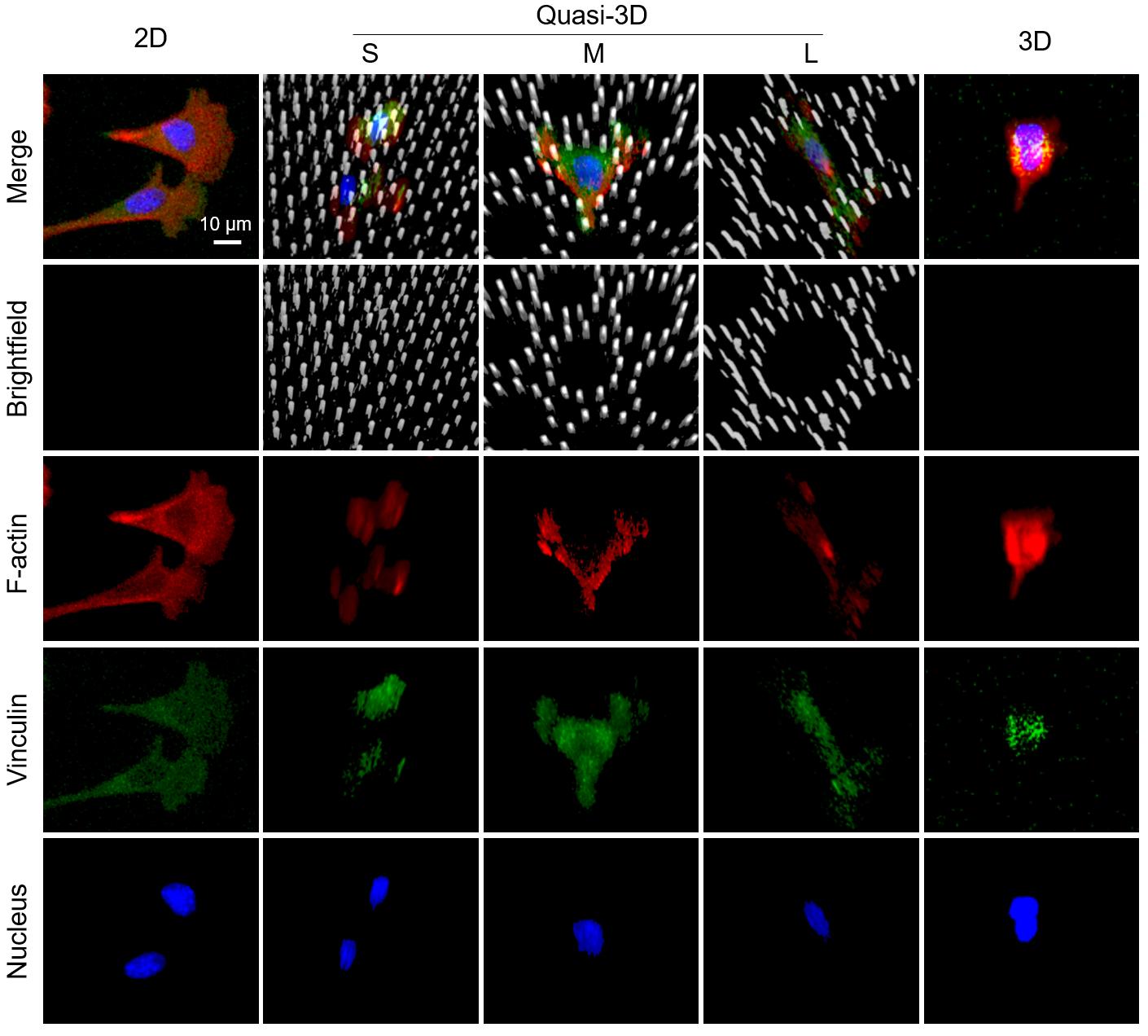
图8. 共聚焦显微镜Z轴层扫的三维叠加图。其中灰色表示材料;红色表示微丝;绿色表示黏着斑蛋白;蓝色表示细胞核。此处,“2D”表示平坦 PDMS 表面上的细胞,“3D”表示基质胶中的细胞,“quasi-3D”表示被PDMS微柱包围的微井中的细胞,其中“S”、“M”和“L”表示小、中、大微井。 细胞在二维和准三维中培养4 h,在三维中培养24 h。 为了考察不同细胞对于三种微环境的响应,将三种细胞在二维、准三维和三维微环境中的细胞响应。这三种细胞分别为hMSC(人骨髓间充质干细胞)、HFF(人包皮成纤维细胞)、HUVEC(人脐静脉内皮细胞)。需要强调的是,这里并没有动用循环拉伸。图9A所示,细胞在二维微环境中4 h内就铺展良好。但在三维微环境中尽管培养24 h,细胞仍然在基质胶中趋于圆形。在准三维微环境中,细胞表现出不同的形态:M使细胞比S和L膜更圆。图9B显示了定量分析的结果。圆度确实是二维<准三维<三维。此外,每个细胞中黏着斑蛋白的积分强度为二维: 准三维:三维= 5:3:1。因此,准三维微环境介于二维和三维之间,且相对更接近三维。在准三维(S、M 和 L)中,M组在所有三类细胞的三个方面(微丝、圆度和细胞面积)均显示出最高值。

图10. hMSC、HFF、HUVEC 细胞的直径(每组n ≥ 100)。图像是在细胞接种到组织培养板 (TCP) 表面20 分钟后拍摄的。所有细胞的大小介于 S 和 M 微井的直径之间。 该研究设计并成功制备了具有可拉伸微结构的微流控芯片,在此基础上构建了细胞的准三维黏附状态并进行循环拉伸刺激。细胞在不同微井阵列中的循环拉伸使得细胞呈现不同水平的扩散、取向、迁移速率和迁移方向性。而被聚合物微柱包围的中等微井引发了最强的细胞反应。研究人员还研究了三种类型的细胞在二维、准三维和三维微环境中的表现;结果证实准三维微环境介于二维和三维微环境,而且在许多方面,适当的准三维细胞可以模仿三维微环境中的细胞,同时又能像在二维上一样方便地观察。该研究为准三维微环境的细胞拉伸提供了有价值的工具,并揭示了生物材料拓扑特征对细胞的复杂影响,从而为不同维度的细胞研究开辟了新途径。
原文链接
https://www.sciencedirect.com/science/article/pii/S2452199X2100582X
免责声明:部分资料来源于网络,转载的目的在于传递更多信息及分享,并不意味着赞同其观点或证实其真实性,
也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。
邮箱:info@polymer.cn
(责任编辑:sun)






 (1)
(1)
 (2)
(2)
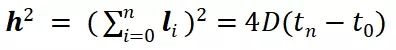 (3)
(3)



