慢性伤口愈合由于高发病率和相关负担已成为一个全球性关注的健康问题,因此促进组织重塑并实现对伤口状态的可视化监测,具有重大意义。传统治疗手段如自体和异体皮肤移植,面临着供体有限以及免疫排斥风险高的困境;临床常用的纱布、绷带等伤口敷料,功能单一,不仅需要频繁消毒与更换,还可能对伤口造成二次伤害。此外,慢性伤口的愈合机制复杂,迫切需要能够精准调控细胞类型与分子机制的新型多功能生物材料。组织工程支架凭借其三维多孔结构,为细胞黏附、增殖、分化提供了良好条件,且具有来源充足、可调节性高等优势;而电刺激也已被证明对伤口愈合过程具有实质性的影响,二者在慢性伤口治疗领域均展现出广阔的应用前景。然而,现有治疗策略在同步实时监测创面愈合状态方面仍存在一定的不足。
鉴于此,福州大学杨黄浩教授、张进教授与福建医科大学第一附属医院吴巧艺主任医师合作,成功研制出一种新型三层结构电子皮肤贴片(TENG-gel)。TENG-gel通过将聚二甲基硅氧烷/聚四氟乙烯薄膜(PDMS/PTFE)、共晶镓铟(E-GaIn)以及季铵盐壳聚糖(QCS)/聚丙烯酰胺(PAAM)/海藻酸钠(SA)@二硫化钼(MoS2)纳米片复合水凝胶(HQPS@MoS2)进行逐层整合,基于摩擦纳米发电机的接触-分离模式,实现了无线自供电功能。TENG-gel具备出色的多模式抗菌性能与炎症控制能力,细菌抑制率高达96.2% ± 1.5%。同时,还能够产生电刺激对伤口微环境进行精细调控,有效刺激细胞活性并推动组织重塑,为加速伤口再生创造有利条件。更为关键的是,温度和应力作为慢性伤口愈合程度的重要评价指标,可基于该电子皮肤贴片在伤口愈合实时监测过程中的电信号变化被间接读取,从而精准反馈伤口愈合的阶段性信息。此外,伤口一旦受到外部环境因素干扰,该皮肤贴片将及时发出警报。总之,这款含有纳米酶的电子皮肤贴片为全球慢性伤口治疗领域的发展注入全新活力,对于医护人员长期高效管理和实时精准监测伤口愈合进程具有重大意义。


图1. 具有多模态抗菌、无线自供电和实时监测特性的TENG-gel E-skin贴片用于慢性伤口修复
【PDMS/PTFE薄膜的物理和自供电性能】
为生成加速细胞迁移和增殖、促进伤口愈合的内源性电场(EF),研究人员成功制备了一种易于电子转移的PDMS/PTFE复合薄膜。通过调整PDMS/PTFE的重量比为100:1、50:1、10:1和5:1,成功制备了4种性能各异的PDMS/PTFE薄膜。实验结果表明,随着PTFE添加量增加,PDMS/PTFE薄膜疏水性和力学性能提升。当重量比为 10:1时,电输出最佳,综合考虑多种性能,后续实验采用此比例薄膜制备皮肤贴片材料。测试表明,PDMS薄膜的短路电流(ISC)仅为11.4 nA,而PDMS/PTFE薄膜的输出电流升高了3.8倍(43.1 nA)(图2F),这主要是由于PTFE的强电子亲和力。具体来说,PTFE的螺旋C链骨架完全被F原子覆盖,F原子具有很强的电负性,与金属原子接触时会吸引电子。此外,作为一种有效的摩擦负性材料,在PDMS微结构表面产生微米或亚微米大小的微小PTFE毛刺也有助于增强PDMS/PTFE薄膜的摩擦电效应,显著提高其电输出性能。与纯PDMS薄膜相比,PDMS/PTFE薄膜表现出更好的自供电功能以形成内源性EF,从而加速慢性伤口的愈合。并且,摩擦电材料在不同的外力作用下展现出不同的输出性能,包括开路电压(VOC)和ISC。在5 Hz固定频率下,当施加的外力从1 N增加到5 N时,ISC和VOC分别从22.4 nA增加到97.5 nA,从1.0 V增加到7.8 V(图2G,H)。图2I,J还显示了PDMS/PTFE薄膜在不同工作频率下输出性能的变化。同样,在固定5 N的作用力大小下,随着工作频率在1~5 Hz范围内的变化,ISC值也呈现出逐渐增加的趋势,而VOC值则无显著差异。这是因为工作频率的增加加速了电荷的感应或转移速率,但在外电路内转移的总电荷仍然保持不变。考虑到电输出性能的稳定性是生物电信号、离子转移和细胞增殖的关键因素,将PDMS/PTFE薄膜浸泡在不同的溶液中或将其暴露在空气中长达36天,展现了其电输出性能的稳定可靠性(图2K?N)。

图2. PDMS/PTFE薄膜的物理特性和电输出性能
【HQPS@MoS?的物理性能、光热性能、类过氧化物酶(POD)活性及抗菌性能】
二硫化钼(MoS?)纳米片通常展现出卓越的光热性能、导电性能、催化活性以及机械强度。具体而言,MoS?纳米片具有可调节带隙,这使MoS?更适合在生物传感和光学传感等领域应用;此外,MoS?纳米片独特的S-Mo-S层状结构与其催化活性相结合,有助于增强复合水凝胶的抗菌性能;更重要的是,MoS?纳米片在水凝胶中的均匀分布赋予了其足够的机械强度以维持水凝胶结构完整性并使其能够承受周围组织施加的压力,从而提高伤口愈合效率。综上所述,研究人员采用液相剥离法,以L-赖氨酸作为剥离剂合成了MoS?纳米片,将其掺入水凝胶中以实现加速伤口愈合并实时监测电信号的功能。

图3. HQPS@MoS2水凝胶的物理、光热、类POD活性和抗菌性能的表征
【TENG-gel皮肤贴片的结构稳定性及双温度/应变传感性能】
研究人员结合PDMS/PTFE薄膜和HQPS@MoS?水凝胶优异的物理、自供电和抗菌性能,开发了一种新型电子皮肤贴片(TENG-gel)以促进慢性伤口愈合并实现实时监测。在PDMS/PTFE薄膜上均匀沉积导电层E-GaIn,为电信号提供传输路径,随后进一步结合负责促进皮肤再生的HQPS@MoS?水凝胶层(图4A)。值得注意的是,研究人员通过100次扭转、弯曲甚至在水中摇晃等实验均显示出TENG -gel的三层界面的完整结合(图4D?H)。这种界面粘附主要归因于E-GaIn与PDMS/PTFE薄膜或HQPS@MoS?水凝胶之间形成的金属配位键,实现了各层之间的稳定连接。此外,Ga3?可能与水凝胶表面暴露的大量羧基/羟基交联,主动与水凝胶形成紧密的界面并抑制E-GaIn液滴扩散到水凝胶内部。除了保持三层之间的紧密连接外,HQPS@MoS?水凝胶通过与多种底物形成丰富的氢键、配位键、共价键以及摩擦力表现出了有效粘附,为电信号传输到伤口提供了可靠的导电途径,有利于促进细胞迁移、加速血管生成和微环境重塑(图4G)。
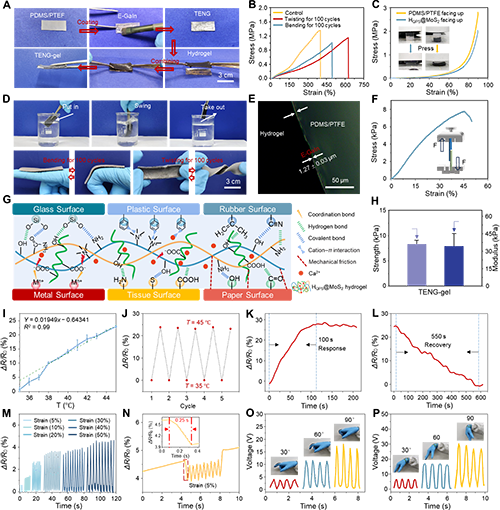
图4. TENG-gel皮肤贴片的结构稳定性及温度/应变双传感性能
【TENG诱导的电刺激电刺激对体外细胞迁移和铺展的影响】
研究人员选用小鼠胚胎成纤维(NIH/3T3)细胞进行细胞毒性和细胞活力检测,验证了HQPS@MoS?水凝胶具有出色的细胞相容性(图5A,E)。细胞划痕实验是模拟伤口愈合过程的代表性体外模型。他们比较了TENG诱导的电刺激(TENG(+))和无刺激(TENG(?))条件下的细胞迁移行为,结果表明电刺激对NIH/3T3细胞的迁移和增殖具有显著影响(图5B,F)。在电刺激下,NIH/3T3细胞的定向迁移产生收缩力使伤口更快闭合。另外,细胞骨架及其结合蛋白是细胞迁移的基础,基于肌动蛋白的微丝决定了细胞的定向运动。如图5C所示,与对照组和TENG(?)组相比,TENG(+)组在两个不同时间点均表现出更丰富的由肌动蛋白聚合形成的片状伪足和丝状伪足(红色箭头),以及更宽且更密集的细胞骨架结构(图5C,G,H)。图5D展示了电刺激诱导三维细胞外基质内的胶原纤维排列为成纤维细胞的形态调整提供接触导向作用。此外,电刺激改变了细胞骨架肌动蛋白的重组,导致伪足形成,并通过在细胞膜周围产生牵引力来促进细胞迁移。其次,电刺激可能通过影响细胞周期、调节离子通道和信号通路(如细胞内钙离子、MAPK/ERK以及PI3K/Akt)来影响细胞的增殖和分化行为。
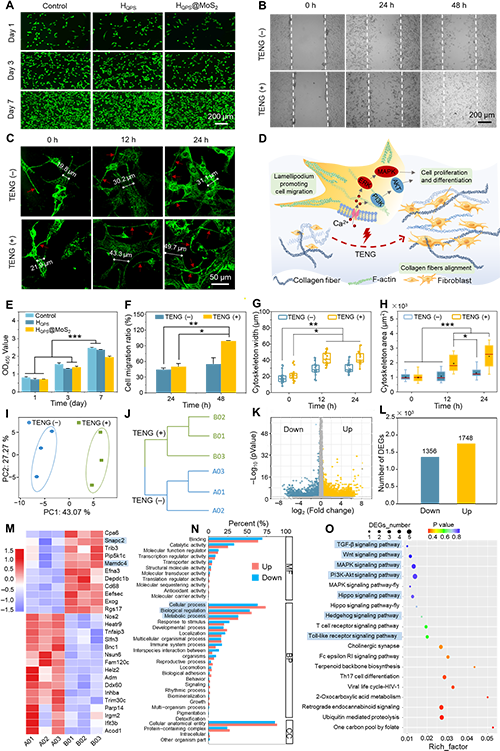
图5. TENG对细胞活力的影响
【体内皮肤再生性能】
鉴于TENG-gel在体外具有出色的抗菌活性、无线自供电能力和双传感性能,研究人员在小鼠全层皮肤缺损模型(缺损直径为7 mm)中评估其皮肤再生性能。在最初的3天,分别使用对照组、商品敷料组、商品敷料 + NIR组、TENG-gel组和TENG-gel + NIR组进行处理,随后在第0、3、6、9、1和14天观察伤口愈合状态。体内的代表性照片、伤口闭合痕迹和伤口收缩面积(图6A?C)显示,处理3天后,对照组和商品敷料组出现严重炎症和化脓现象。由于一定程度的感染,除TENG-gel + NIR组外,其他组在术后第9天出现明显的疤痕和结痂现象。一方面,由于HQPS@MoS?水凝胶具有卓越的吸水性能,TENG-gel的内层有效地吸收分泌物,降低局部伤口张力并保持伤口表面干燥。另一方面,PDMS/PTFE薄膜理想的疏水特性使其对任何表面物质的粘附力极低,从而确保了防污性能,有效地保护伤口免受外部污染物的侵害。
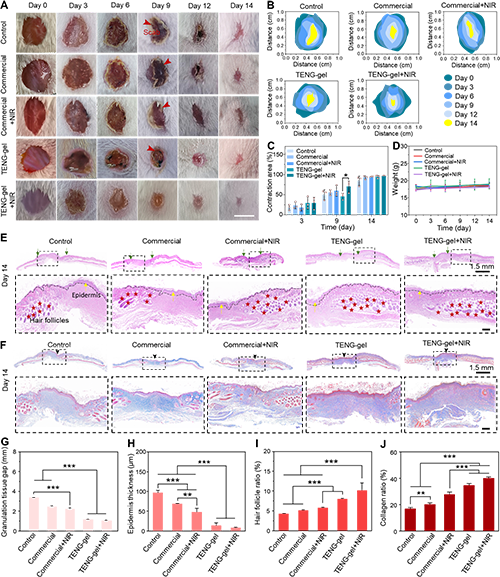
图6. TENG-gel电子皮肤贴片在体内促进伤口愈合的作用
【体内组织学、免疫组织化学及生物安全性分析】
为了仔细研究伤口部位促炎细胞因子或生长因子的表达水平,研究人员对伤口组织进行了免疫组化分析,进一步探究伤口愈合的潜在机制。值得注意的是,伤口感染的严重程度通常与典型促炎因子如白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平的升高相关,这些是细菌感染临床诊断的敏感指标。如图7A所示,在对照组的伤口部位可以清楚地观察到大量促炎细胞因子标志物(棕色)。特别是IL-6的表达,第7天时TENG-gel + NIR处理组与对照组相比降低了约8.9倍,这表明所制备的TENG-gel皮肤贴片通过减少感染有效地促进了伤口恢复(图7C,D)。具体而言,在伤口愈合的初始阶段,电刺激激活了ERK/P13K信号通路,促进离子通道上调和Ca2?内流。特别是巨噬细胞中类似TRPV2的Ca2?内流,调节免疫细胞活性并增强细菌吞噬作用,减轻严重炎症。而在随后的增殖阶段,电刺激通过激活ERK1/2/p38丝裂原活化蛋白激酶信号通路进一步抑制IL-6的表达,有助于形成抗炎微环境。

图7. 体内不同组别伤口组织的组织学、免疫组化和生物安全性分析
【体内伤口愈合的实时信号监测与精准反馈】
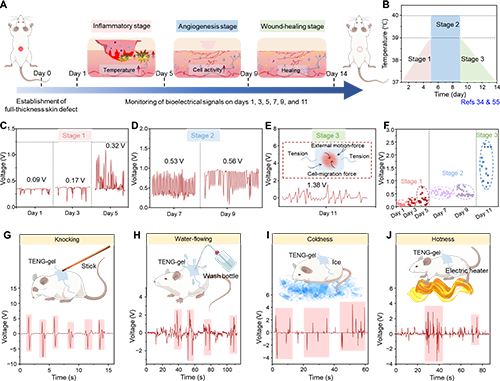
图8. TENG-gel皮肤贴片实时监测的体内评价
论文共同第一作者为福州大学化学学院研究生刘婉玲以及福建医科大学第一附属医院研究生叶君成。通讯作者为福州大学化工学院张进教授、化学学院杨黄浩教授,以及福建医科大学第一附属医院吴巧艺主任医师。
原文链接:https://doi.org/10.1002/adfm.202424698
- UCLA 金丽华教授团队 AFM:通过非平衡过程实现形状记忆聚合物可编程多模态形状演化 2025-12-23
- 华中科技大学吴豪教授 AFM:多模态表皮传感器驱动的痉挛等级客观评估 2025-11-23
- 东北大学王铁强/孟凡宝、四川轻化工大学付昱 CEJ:适用于复杂应用场景的多模态自感知水凝胶致动器 2025-09-18
- 东华大学朱美芳教授、贾超副研究员等 AFM:抗菌、制冷多功能聚乙烯纤维防护材料 2026-01-06
- 华东理工刘润辉教授课题组 Nat. Commun.:双胍化多肽模拟物抗多药耐药ESKAPE与脑膜炎 2025-12-12
- 浙大张庆华教授团队 AFM:定制化多功能Janus织物 - 实现透气、抗菌与舒适个人热湿管理 2025-11-19
- TIBI朱杨志教授团队 AM:一款新型柔性、高透气性、自粘附且可生物降解的气凝胶基电子皮肤贴片用于实时连续检测多种生物标记物水平 2022-12-31
