英国爵士/四院院士/牛津大学 Molly Stevens教授课题组 Nat. Commun.:非侵入性细菌感染检测纳米传感器
2024-12-01 来源:高分子科技
金黄色葡萄球菌(包括耐甲氧西林菌株)是导致外科植入物相关感染的主要原因,通常形成难以清除的生物膜,增加治疗难度和成本。现有检测方法如细菌培养、PCR、ELISA等尽管敏感性和特异性较高,但需侵入性采样,耗时长、成本高,并可能引入污染风险。为此,亟需开发一种非侵入性、原位检测植入物感染的诊断方法,以实现更早期、更高效的感染识别。
鉴于此,牛津大学四院院士Molly Stevens教授课题组报道了一种非侵入性的体内细菌植入感染的生物检测传感器,该检测系统利用金纳米簇(AuNCs)的催化性能,将其封装在对金黄色葡萄球菌毒素响应的脂质体中,通传感器在细菌毒素作用下释放AuNCs并生成比色信号,并在小鼠感染模型中验证了其无创诊断植入物感染的有效性,该平台具有广泛应用潜力和成本优势。
文章要点
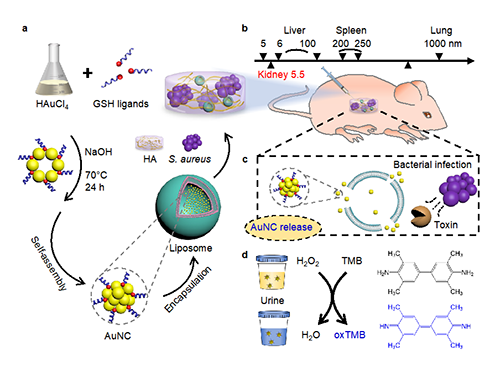
图一:金纳米簇封装的脂质体生物传感器的设计及其检测细菌植入感染的机制
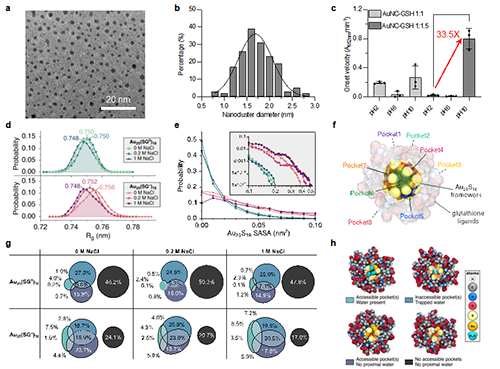
图二:金纳米簇的优化、表征与模拟
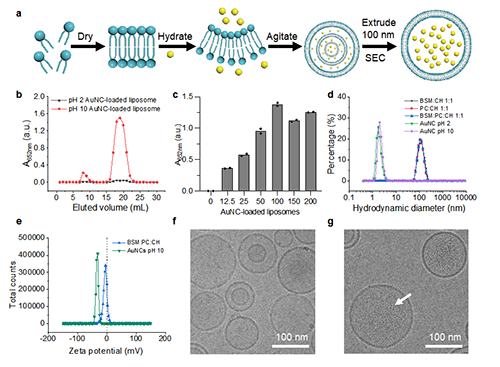
图三: 金纳米簇封装的脂质体传感器的组装与表征
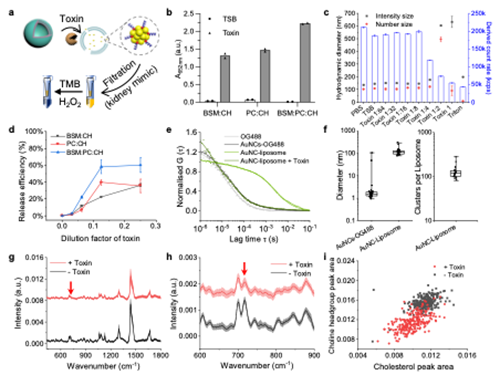
图四:由不同脂质配方组成的金纳米簇封装脂质体对细菌毒素的体外响应
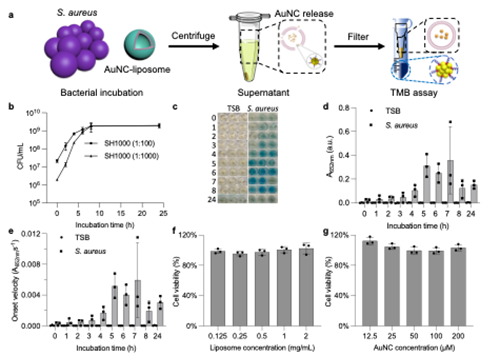
图五:金纳米簇封装的脂质体与细菌的体外共培养及细菌生长表征
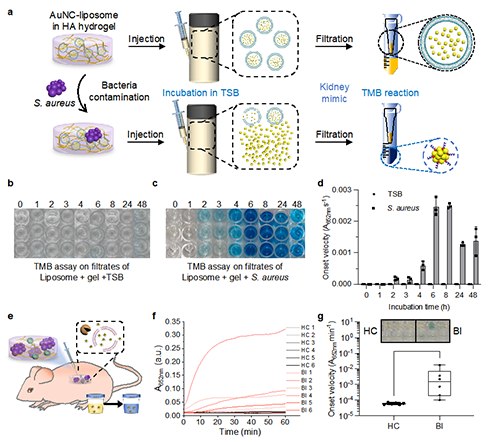
图六:实现细菌感染状态比色读出的金纳米簇脂质体传感系统
论文链接:https://doi.org/10.1038/s41467-024-53537-2
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 加州理工学院高伟课题组 Adv. Mater.:QuantumDock自动化计算框架指导基于分子印迹聚合物的可穿戴生物传感器构筑 2023-05-13
- 南方医科大学邱小忠、侯鸿浩教授 Nat. Commun.:一种用于非侵入性心肌修复和防止术后组织粘连的智能黏附性Janus水凝胶 2022-12-14
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 西安交大郭保林教授、憨勇教授、赵鑫副教授团队 NSR:在耐药细菌感染的运动部位创面全过程管理上取得新进展 2025-06-12
- 华科大刘国辉教授团队 ACS Nano:导电水凝胶激发中性粒细胞胞外捕获器对抗伤口细菌感染 2025-03-07
- 中科院理化所王树涛/张飞龙团队《Adv. Mater.》:在凝胶形状转变的调控研究方面取得新进展 2026-01-30
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
