近日,东华大学李静超分别以“Breast Cancer Bone Metastasis Therapy and Tumor-Associated Bone Destruction Repair by Versatile Semiconducting Nanointegrators with X-ray Adjuvant”和“Two-Step Targeting-Tunable Semiconducting Nanoswitches Amplify Mitochondrion Damage and PD-L1 Blockade for Orthotopic Pancreatic Cancer Therapy”为题在Adv. Funct. Mater.上发表了两篇最新研究论文。分别介绍如下:
《Adv. Funct. Mater.》:多功能半导体纳米整合器用于乳腺癌骨转移治疗和骨损伤修复
骨是几种晚期肿瘤的主要转移组织。骨转移瘤可引起脊髓压迫、高钙血症和病理性骨折等骨相关事件,会导致患者生活质量下降和生存率降低。化疗被认为是临床上治疗骨转移的主流选择,但由于骨转移微环境的复杂性,化疗难以达到满意的治疗效果。此外,肿瘤进展和肿瘤相关的骨溶解是乳腺癌骨转移的两个关键问题,给骨转移治疗带来了挑战。转移性肿瘤细胞促进破骨细胞的募集和活性,引起骨吸收和骨损伤;破骨细胞和肿瘤细胞积极参与构建适合转移性肿瘤细胞定居的骨微环境,形成肿瘤生长和骨破坏的恶性循环。因此,有效的骨转移治疗应同时考虑肿瘤清除和骨组织修复。

基于以上背景,东华大学李静超研究团队设计了一种多功能半导体纳米整合器(SPNCpG/Ca),通过联合放疗、钙超载以及免疫治疗,实现骨转移瘤的治疗和肿瘤相关骨损伤修复。半导体聚合物纳米颗粒(SPN)作为放疗增敏剂产生的活性氧在用于放射治疗的同时还能够破坏活性氧响应片段,从而释放免疫佐剂CpG。因此,SPNCpG/Ca介导的活性氧产生、钙超载以及释放的CpG能够造成细胞死亡和免疫反应的激活。在乳腺癌骨转移小鼠模型中,这种联合治疗策略可有效抑制骨转移瘤的生长和肝肺转移。此外,Ca2+可加速骨髓间充质干细胞成骨分化,而CpG能够在骨转移微环境中抑制破骨细胞分化来缓解骨溶解,两者协同促进肿瘤相关骨损伤的修复(图1)。这种多功能的治疗性纳米系统,具有治疗骨转移和修复肿瘤相关骨损伤的能力,为骨转移的治疗提供了新策略。
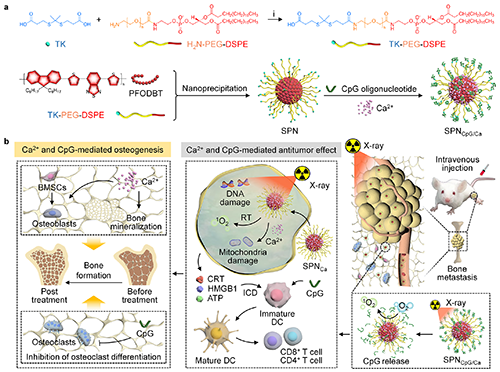
图1. SPNCpG/Ca的合成路线及治疗机制示意图
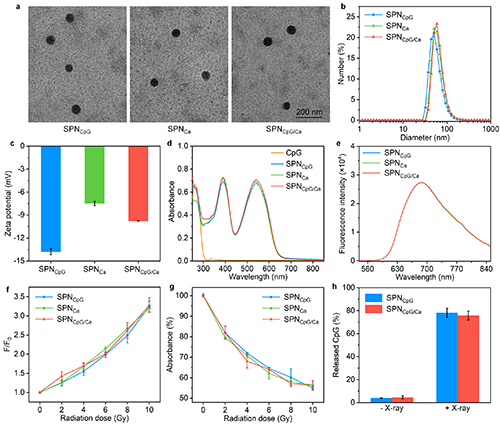
图2. SPNCpG/Ca及其对照材料的体外表征
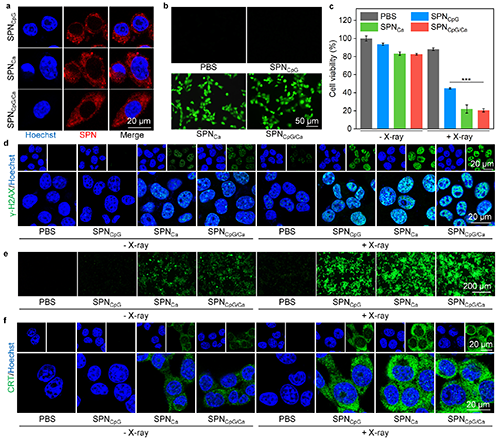
图3. 体外SPNCpG/Ca治疗效果和作用机制的评价
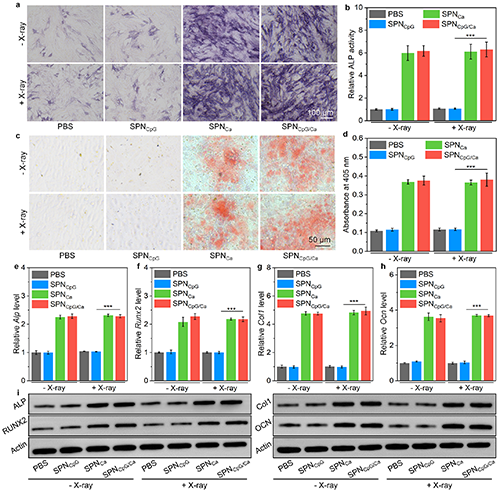
图4. 体外SPNCpG/Ca的成骨效果评价
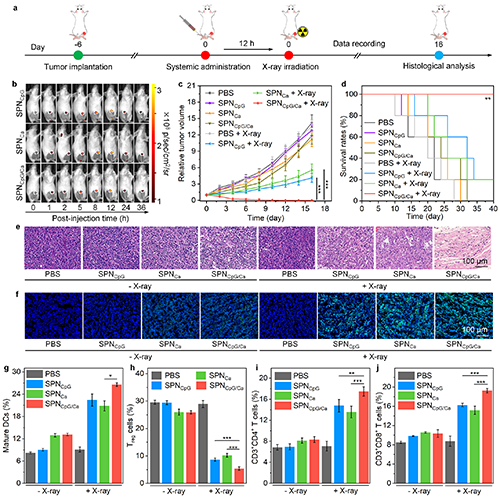
图5. 肿瘤富集、体内治疗效果及作用机制的评价
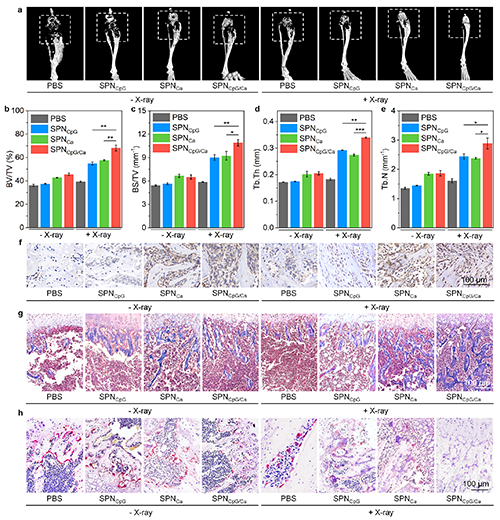
图6. 体内成骨和肿瘤相关骨损伤修复评价
总而言之,该多功能纳米整合器在骨转移瘤的治疗和肿瘤相关骨损伤修复中具有显著优势:(i)X射线和半导体聚合物的联合在促进活性氧产生的同时,实现了免疫佐剂CpG的可控释放;(ii)放疗、钙超载和免疫激活的联合策略实现了对骨转移瘤生长的有效抑制,提高治疗效果;(iii)Ca2+和CpG不仅作为治疗药物发挥抗肿瘤疗效,还分别通过促进成骨和抑制破骨细胞分化实现肿瘤相关骨损伤的修复,这在提高肿瘤治疗效果的同时实现了骨损伤部位的骨形成。
该研究成果以“Breast Cancer Bone Metastasis Therapy and Tumor-Associated Bone Destruction Repair by Versatile Semiconducting Nanointegrators with X-ray Adjuvant”为题发表在Advanced Functional Materials。东华大学硕士研究生张伊婧和刘玥为该论文第一作者;东华大学李静超研究员和上海大学张琴副研究员为论文通讯作者。该研究工作得到国家自然科学基金、上海市科委、上海市高等学校特聘教授(东方学者)和中央高校基本科研业务基金的资助。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202412165
《Adv. Funct. Mater.》:两步可调型半导体纳米转换器放大线粒体损伤和PD-L1阻断用于原位胰腺癌治疗
胰腺癌是一种具有丰富细胞外基质和高度免疫抑制微环境的极恶性肿瘤,其治疗仍然是一个巨大的挑战。近日,东华大学李静超设计了一种半导体纳米转换器(C/SPNT/αP),通过放大线粒体损伤和程序性死亡配体1(PD-L1)阻断,实现原位胰腺癌治疗。

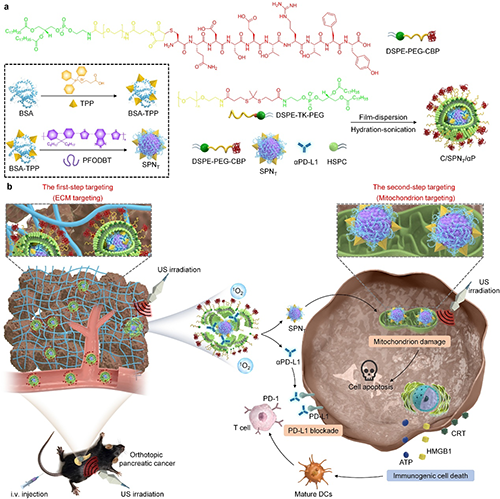
图1. 两步靶向可调型C/SPNT/αP的合成路线及治疗原位胰腺癌示意图。
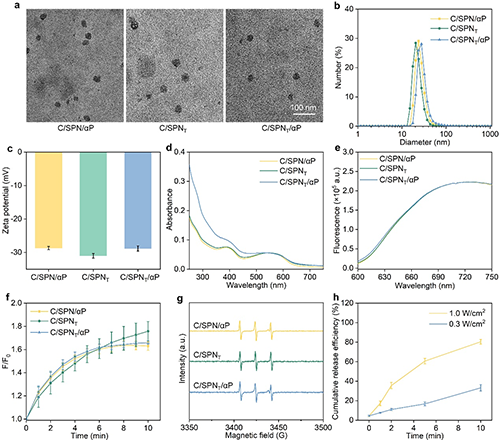
图2. C/SPNT/αP及其对照材料的体外表征
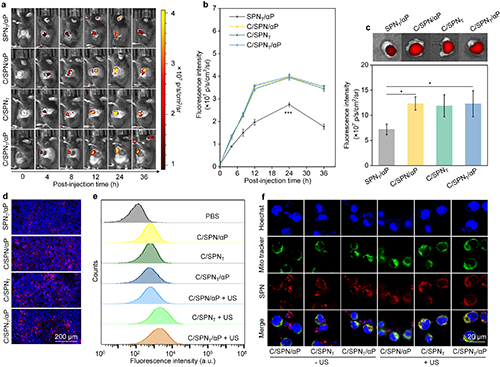
图3. 两步靶向可调效果评价
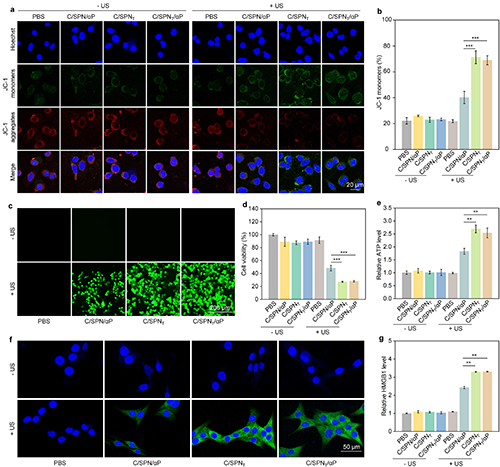
图4. 体外线粒体损伤及ICD反应评价
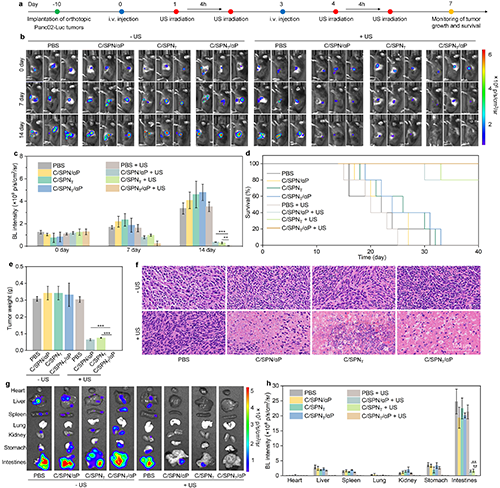
图5. 体内原位Panc02肿瘤模型的治疗疗效研究
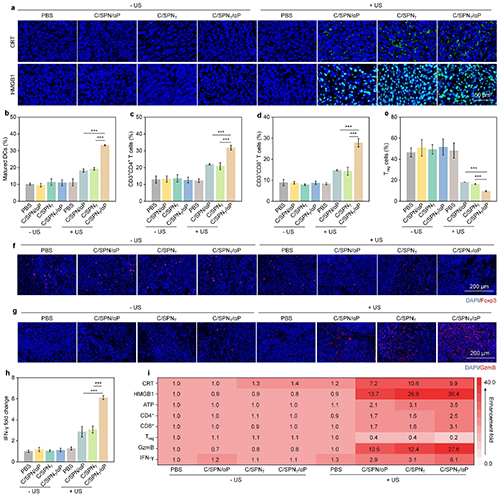
图6. 原位Panc02肿瘤免疫激活的评价
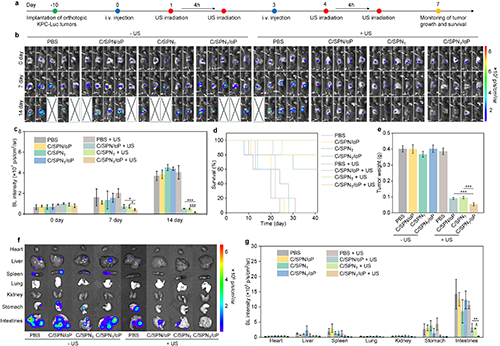
图7. 原位KPC肿瘤治疗疗效研究
该研究成果以“Two-Step Targeting-Tunable Semiconducting Nanoswitches Amplify Mitochondrion Damage and PD-L1 Blockade for Orthotopic Pancreatic Cancer Therapy”为题发表在Advanced Functional Materials。论文第一作者为东华大学研究生李子超,通讯作者为东华大学李静超研究员。该研究工作得到上海市科学技术委员会和国家自然科学基金的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202413233
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
