肿瘤微环境(TME)具有与正常组织截然不同的特征包括弱酸性、高水平活性氧(ROS)和谷胱甘肽(GSH)以及免疫失调等,现已成为肿瘤治疗考虑的主要因素。化学动力学治疗(CDT)因其治疗特异性高和侵袭性低在近年来成为癌症治疗的热点。课题组先前研究结果表明,由过渡金属如铁(Fe)、铜(Cu)和锰(Mn)组成的纳米粒子(NPs)能够响应特定的TME,消耗肿瘤组织中内源性过量H2O2,并通过芬顿/类芬顿反应生成大量有毒的?OH,导致细胞氧化应激失衡和凋亡,从而实现理想的CDT(Adv. Mater., 2022, 34, 2107009;Nano Today, 2021, 41, 101325; ACS Nano, 2023, 17, 23889-23902)。Cu基金属NPs介导的类芬顿反应能够在弱酸性和中性介质中发生,其反应速率远高于基于Fe2+的芬顿反应。此外,独特的磁共振(MR)弛豫性能使Cu基NPs成为一种潜在的T1加权MR成像造影剂。
内质网(ER)作为调节生物功能的主要细胞器,在蛋白质折叠和运输过程中发挥着重要作用,被认为是理想的治疗靶点。癌细胞可通过缓解ER应激从而使自身得以存活,因而诱导放大内质网应激成为高效杀灭癌细胞的新兴策略。一方面,丰加霉素(Toy)已被作为XBP1剪接的抑制剂,可以下调促癌生存通路,从而放大ER应激(Adv. Mater., 2022, 34, 2206861; Adv. Sci., 2023, 10, 2301759);另一方面,CDT诱导的氧化应激将严重加剧ER应激,在这种情况下,癌细胞会持续处于未解决的ER应激状态,最终导致癌细胞的免疫原性细胞死亡(ICD),激发免疫响应。
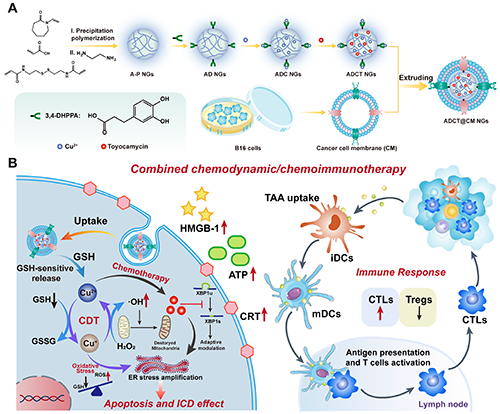
图1. ADCT@CM NGs的合成(A)及其用于MR成像引导肿瘤化疗-化学动力学治疗-免疫治疗(B)的示意图。
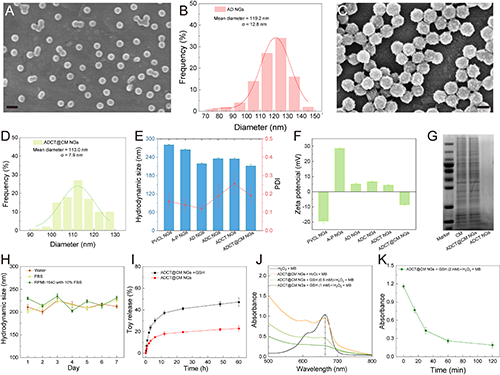
图2. AD NGs的SEM图像(A)和尺寸分布直方图(B)。ADCT@CM NGs的 SEM 图像(C)和尺寸分布直方图(D)。(E)不同材料的流体力学尺寸和PDI以及(F)zeta电位。(G)CM、ADCT NGs和ADCT@CM NGs的SDS-PAGE分析。(H)一周内ADCT@CM NGs 在水、PBS和细胞培养基(RPMI-1640,含10% FBS)中分散时的水动力尺寸变化。(I)在GSH存在或不存在的情况下,ADCT@CM NGs在PBS中的Toy累积释放量。(J)不同反应体系下,MB的紫外-可见光谱。(K)不同时间点下,反应体系中MB的降解情况。

为了验证ADCT@CM NGs通过CDT和化疗产生的ICD效应,研究团队检测了B16细胞经不同材料处理后危险相关分子模式的变化。结果表明,ADCT@CM NGs组的CRT表达水平、HMGB-1和ATP释放量明显高于其他组(图4A-C),这是由于生物仿生NGs可增强细胞对Cu(II)和Toy组分的摄取,从而有效诱导ICD效应,而CDT和化疗导致的细胞凋亡和坏死是ADCT@CM NGs介导ICD的主要机制。进一步地,ADCT@CM NGs的处理能够在体外显著促进DCs的熟化以及MHC-I的表达,表明DCs的抗原呈递能力增强,有望在体内刺激特异性T细胞激发免疫应答(图4D-G)。此外,ELISA结果表明与DCs成熟相关的细胞因子TNF-α和IL-12p70的分泌水平增加(图4H-I)。

体内实验结果表明,相比于单一的治疗方式,联合治疗组ADCT@CM NGs在Cu(II)介导的CDT和Toy的化疗作用以及CM的同源靶向下,显著抑制了小鼠肿瘤的生长效率,体重没有明显下降,展现出良好的生物安全性。H&E、TUNEL、Ki-67、ROS染色结果表明,ADCT@CM NGs可通过促进氧化应激/凋亡/坏死有效抑制肿瘤生长。接下来,团队研究了ADCT@CM NGs在体内的抗肿瘤机制,图5表明纳米平台能够在体内促进肿瘤细胞CRT的表达,诱导产生ICD效应,上调血清中免疫细胞因子TNF-α、IL-6和IFN-γ的含量。同时,团队研究了T细胞的分布情况。ADCT@CM NGs治疗后小鼠脾脏中CD4+ T和CD8+ T细胞数量明显增多,肿瘤浸润性CD3+CD4+ T细胞和CD3+CD8+ T细胞比例上调,Tregs比例下调,这表明联合疗法能够有效重塑免疫抑制的TME。所开发的NGs主导的化学动力学/化学免疫疗法,可通过氧化应激放大、ICD诱导和CTLs激活,从而实现积极的TME调节和抗肿瘤效应改善。

图5.(A)不同处理15天后肿瘤切片中CRT的免疫荧光染色和(B)定量分析。ELISA检测不同组治疗后血清细胞因子(C)TNF-α、(D)IL-6和(E)IFN-γ水平。肿瘤浸润性CD3+CD4+ T细胞(F)、CD3+CD8+ T细胞(H)和Tregs细胞(J)的代表性流式细胞术分析图。肿瘤浸润性CD3+CD4+ T细胞(G)、CD3+CD8+ T细胞(I)和Tregs细胞(K)的比例。
简而言之,该研究设计的NGs体系具有以下优势:1)所构建的氧化还原反应性NGs与CM的结合提高了Cu(II)和Toy的生物利用度,能够在TME下响应性释放,从而通过增强氧化应激和ER应激的双重途径引发肿瘤细胞的凋亡和坏死; 2)Cu(II)介导的CDT和Toy介导的化疗协同增强了ICD效应和免疫反应,从而引发基于T细胞的肿瘤免疫疗法;3)表面CM的包覆以及含Cu(II)的NGs可实现肿瘤特异性T1 MR成像。所开发的NGs结合了Cu(II)、Toy和CM的优势,为全面调节TME的治疗性纳米平台的开发提供了新策略。
文章链接:https://doi.org/10.1016/j.actbio.2024.09.030
- 南京大学王炜/曹毅/薛斌团队 Nat. Commun.:仿生分级picot纤维水凝胶涂层实现超低摩擦与高耐磨性 2026-02-09
- 武汉大学刘兴海教授团队《Small》:仿生超韧快速响应水凝胶 2026-02-02
- 仿生“阴阳耦合”+ 多尺度纳米限域效应!上海交大黄小彬团队 AFM:研发高性能光热滑爽聚脲防除冰涂层-为户外设备抗冰提供新思路 2026-01-31
- 华科大李子福教授 Nat. Commun.:相变纳米凝胶赋能生物医学新突破 2025-12-22
- 山东大学栾玉霞教授团队 Nat. Nanotech.:发现解决CAR-T细胞疗法实体瘤疗效受限的有效方法 2025-05-20
- 东华大学史向阳教授团队:外泌体包裹的响应性树状大分子纳米凝胶可实现急性肺损伤的免疫调节和抗氧化联合治疗 2025-05-15
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
