术后粘连是手术创伤后损伤部位与邻近器官或组织之间形成的异常组织增生,多见于腹膜、子宫、肌腱、心脏等软组织。主要形成诱因包括机械损伤、出血、异物反应、氧化应激、炎症反应等。术后粘连引起的并发症严重影响患者的身心健康,甚至可能危及生命。例如,90%的腹部手术后患者会出现术后腹腔粘连,从而引起慢性盆腔疼痛、肠梗阻、器官功能障碍等急性并发症。此外,接受剖宫产、刮宫或子宫肌瘤切除术的女性易发生宫腔粘连(IUA),可能进一步导致不孕问题。具有湿粘附特性的物理屏障材料可以在有水、血液和渗出液存在的情况下粘附在内脏器官表面而无需缝合,从而防止组织进一步粘附并促进创面愈合。然而,组织基质表面存在的水化层严重阻碍了粘合剂与基质之间的相互作用,导致大多数报道的粘合剂湿粘合作用失败。同时,粘合剂的溶胀作用降低了粘附界面处粘附作用基团的密度,从而降低了耗散矩阵的机械强度。此外,现有粘合剂无差别的双面粘连特性增加了术后粘连的风险。
在自然界中,一些海洋生物,如藤壶、贻贝和沙堡蠕虫,通过分泌含有儿茶酚基团的物质紧密附着于潮湿材料表面。因此,借助儿茶酚基团与基质表面之间的氢键和共价交联等相互作用原理,已开发出大量具备湿粘合特性的仿生生物粘合剂。但是,单纯依靠儿茶酚基团作用的粘合剂仍然受到水化层的影响,从而导致实际应用过程中粘合剂的粘附稳定性和强度急剧降低。近年来,基于脱水粘合机制制备的湿粘附粘合剂引起了广泛关注。其中,具有微结构的粘合剂可以通过毛细管作用力快速吸收界面上的流体,该方式比无微结构的干基质或利用疏水排斥液体效应的粘合剂更快、更有效。因此,将简单的毛细管液体吸收作用与儿茶酚基团介导的粘附机制相结合,有望实现稳定、增强的湿粘附效果。

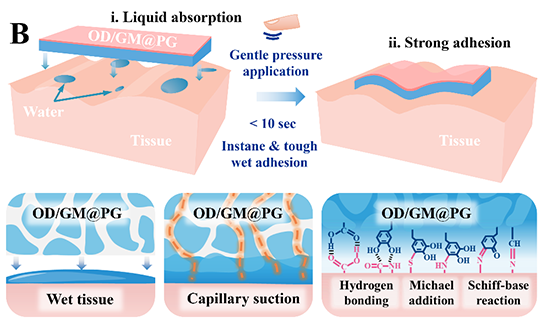
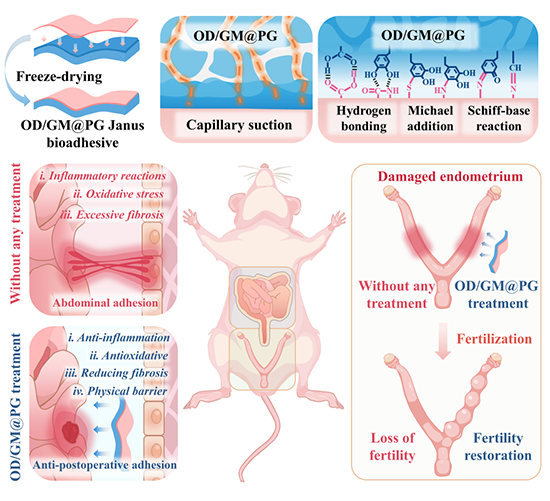
图1. Janus生物粘合剂(OD/GM@PG)的制备流程与湿粘附示意图

图2. Janus 生物粘合剂结构以及毛细管作用力模拟

图3. Janus生物粘合剂粘附性能表征

图4. Janus生物粘合剂防腹腔粘连效果
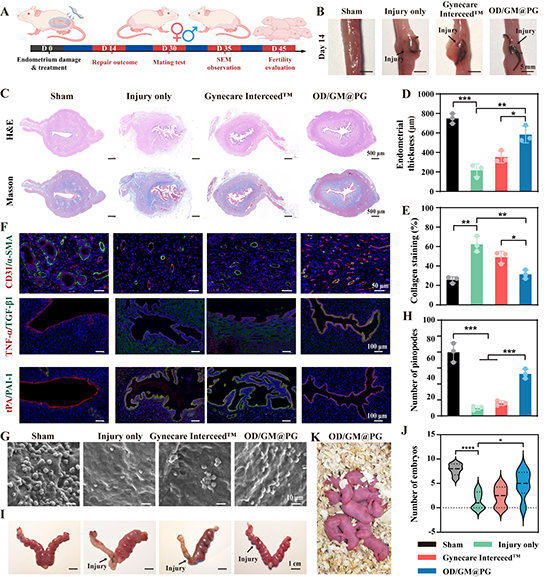
图5. Janus生物粘合剂防子宫内粘连以及生育恢复能力
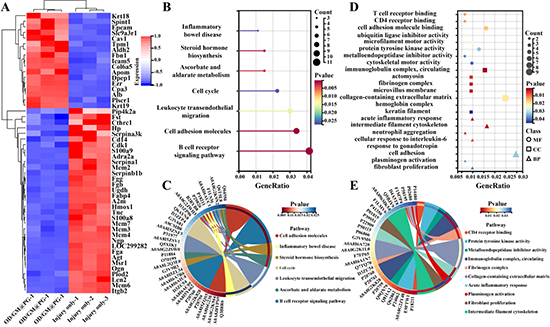
图6. 蛋白组学分析防子宫内粘连机制
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202314402
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 哈工大潘昀路教授团队 AFM:从“破乳”入手的肾小球仿生纳米纤维膜 - 实现微纳乳液高通量分离 2026-02-25
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 南方医大吴耀彬、王玲、黄文华 AFM:原位光固化弹性聚酯基Janus生物粘合剂用于动态创面闭合 2025-05-08
- 浙工大冯杰/张静团队、浙江省人民医院周佳 AHM:用于组织修复和预防术后粘连的“Janus”两性离子水凝胶贴片 2024-12-10
- 北航樊瑜波教授、李晓明教授 AFM:构建负载姜黄素的PLLA/PCL微纳共轭纤维膜从多个角度协同防止术后粘连 2024-09-02
- 南方医大王玲/吴耀彬/区彩文/黄文华《Sci. Adv.》:可注射光固化Janus水凝胶递送外泌体用于减少心脏手术后粘连 2023-08-09
