近年来,免疫治疗逐渐兴起,成为与手术、放疗和化疗并重的新一代肿瘤疗法。然而,受到肿瘤微环境(TME)中多种免疫抑制因素的影响,单一模态的免疫疗法往往无法产生强有力的抗肿瘤免疫反应,治疗效果有限。因此,深入挖掘肿瘤的发生发展机制,针对TME的特点,发展更为高效的联合免疫治疗方法十分重要。纳米药物递送系统的快速发展为联合免疫治疗提供了诸多机遇。其中,锰基纳米材料受到广泛关注。含锰化合物,如二氧化锰(MnO2)可以对TME高含量的谷胱甘肽(GSH)、过氧化氢(H2O2)和弱酸性 pH作出响应,产生Mn2+实施基于类芬顿反应的化学动力学治疗,催生肿瘤细胞免疫原性死亡(ICD),实现TME调节和磁共振(MR)成像。同时,Mn2+也对抗肿瘤免疫中的cGAS-STING通路具有重要激活作用,具有免疫激活剂的功能。因此,设计合适的纳米药物递送系统集成Mn的多重功能,有望实现强效的抗肿瘤免疫治疗。
近期,基于第五代聚酰胺-胺树状大分子,团队构建了一种表面修饰聚乙二醇和苯硼酸,内部包裹MnO2纳米颗粒的树状大分子(MnO2@G5-mPEG-PBA,简称MGPP),并以其为载体构建了天然酶葡萄糖氧化酶(GOx)和STING激动剂环二核苷酸cGAMP的共递送系统(图1a)。该体系有效集成了Mn的多重功能,在进行肿瘤局部给药后,能够在TME中释放出Mn2+,实施肿瘤的MR成像,并与天然酶和环二核苷酸的功能产生良好协同作用,通过化学动力学/饥饿/免疫治疗三重激活全身性抗肿瘤免疫反应(图1b)。
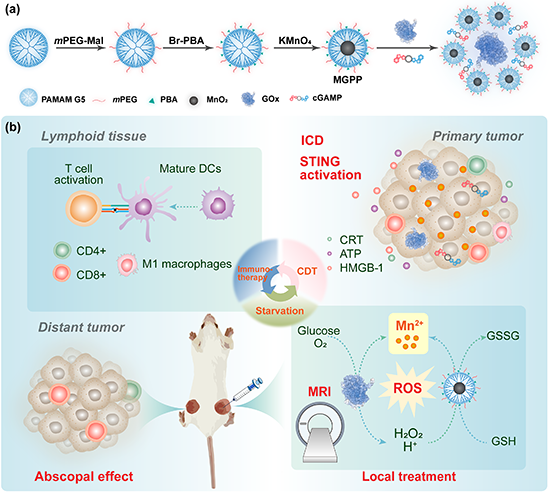
图1. (a)MGPP 的合成路线及负载GOx和(b)cGAMP用于联合治疗的示意图。
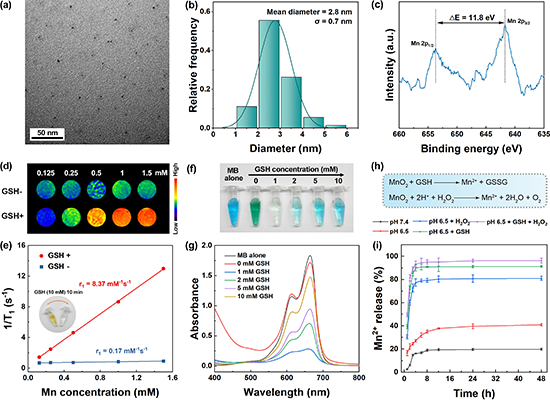
研究团队建立了小鼠双侧皮下CT26结直肠癌肿瘤模型,按图3a所示时间线进行了抗肿瘤实验评价。实验结果发现,21天的实验周期内各实验组小鼠体重缓慢增长,各组别之间无明显差异,表明材料注射后均不存在明显的系统毒性(图3b)。通过监测肿瘤体积变化,发现瘤内注射MGPP/GOx + cGAMP能显著抑制小鼠原发肿瘤的生长,肿瘤抑制率(TSR)高达 99.2%(图3c)。从各组荷瘤小鼠的个体原发肿瘤生长曲线(图3d)、远端肿瘤生长曲线(图3e)和治疗最后一天的照片(图3f)可以更为直观地看出,相比于其他实验组,经MGPP/GOx + cGAMP 治疗后,小鼠的原发和远端肿瘤几乎完全消退,小鼠的总体存活率大大提升,所有的小鼠存活时间均能达到120天。与此同时,团队使用单侧荷瘤小鼠模型,验证了共递送体系的体内MR成像效果。对荷瘤小鼠注射与抗肿瘤实验中相同剂量的MGPP/GOx + cGAMP后,能观测到肿瘤部位的MR信号明显增强(图3g),且注射30分钟后肿瘤部位信噪比即达到峰值(图3h),表明共递送体系在肿瘤部位能够快速释放Mn2+离子,实施MR成像监测。
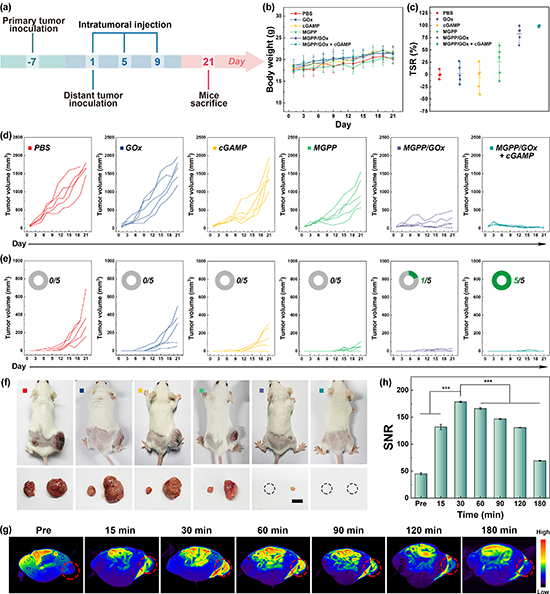
图3.(a)小鼠双侧 CT26 肿瘤建立和抗肿瘤实验评价流程示意图。(b)肿瘤小鼠经不同材料处理后的 TSR、(c)体重变化、(d)原发肿瘤和(e)远端肿瘤体积变化。(e)中插图显示120 天后各组小鼠的存活数量。(f)各组荷瘤小鼠在治疗21天后的代表性照片,肿瘤照片中右边为原发肿瘤,左边为远端肿瘤。比例尺 = 1 厘米。荷瘤小鼠肿瘤局部注射MGPP/GOx + cGAMP后不同时间点的(g)T1 MR成像伪彩图和(h)信噪比值。

图4. 各实验组小鼠原发肿瘤切片的代表性(a)TUNEL、(b)H&E 和(c)CRT 染色图片。比例尺 = 100 μm。(d)各实验组小鼠原发肿瘤中 STING、p-STING、TBK1、p-TBK1、IRF-3 和 p-IRF3 表达水平的 Western Blot分析及(e)蛋白表达定量结果图。各实验组小鼠血清中(f)TNF-α、(g)IL-6 和(h)IFN-γ的ELISA检测结果。
为验证小鼠系统性抗肿瘤免疫反应的激活,团队进一步对各实验组小鼠脾脏T细胞群进行了流式分析,并对小鼠肿瘤和瘤周淋巴结组织进行了免疫荧光染色。实验结果表明,相比于其他实验组,经过共递送体系局部治疗后的小鼠脾脏中分布有最多的CD8+ T细胞和最少的免疫抑制型Treg细胞,原发肿瘤组织中具有显著多的T细胞浸润和抗肿瘤M1表型巨噬细胞分布,淋巴结中也观测到更多的成熟树突细胞,验证了系统性抗肿瘤免疫反应的产生。同时,通过体内安全性评价,团队发现该体系介导的肿瘤局部治疗安全性好,不会过多地蓄积于主要脏器及产生不良影响,有望发展成为一种安全高效的免疫治疗策略。
论文链接:https://doi.org/10.1021/acsnano.3c08174
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学史向阳教授团队:外泌体包裹的响应性树状大分子纳米凝胶可实现急性肺损伤的免疫调节和抗氧化联合治疗 2025-05-15
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 华东理工刘润辉教授课题组《Nat. Biotechnol.》:基于宿主防御肽模拟物组装体的共递送组合体内协同治疗耐药真菌感染 2026-01-02
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 东华大学沈明武研究员/史向阳教授团队:铜掺杂层状双金属氢氧化物共递送蛋白/药物调控肿瘤双重代谢实现级联的化学动力学/免疫治疗 2025-02-08
- 东华大学史向阳教授团队:微流控合成纤连蛋白包覆的聚多巴胺纳米复合物用于自补充肿瘤微环境调节和MR成像引导下的三模态联合治疗 2023-06-01
