宫颈癌是危害妇女健康的重大疾病之一,位于全世界女性恶性肿瘤发病的第三位[1]。高危型人乳头瘤病毒(HPV)感染是引发宫颈癌的主要原因[2]。其中,70%的宫颈癌是由HPV16和HPV18这两种亚型引起的[3]。HPV可以致癌的重要原因是它可以表达E6和E7两种癌蛋白,促进细胞的异常增殖,从而引起肿瘤的发生与发展[4]。目前,预防和治疗HPV感染的方法有干扰素治疗、物理疗法等,但这些都无法彻底清除HPV感染,甚至会导致宫颈机能不全[5]。而HPV疫苗虽可来预防HPV感染,但是在已经感染了HPV的人群中,疫苗目前却是无效的[6]。
现今,随着基因药物的不断发展,基因治疗在抗肿瘤中的应用愈发受到研究者和临床工作者的青睐。随着基础医学的不断发展,越来越多的重组质粒技术开始发展起来,如靶向基因敲除的规律成簇间隔短回文重复(CRISPR/Cas)重组质粒等[7]。利用CRISPR/Cas9技术可切割HPV癌基因,进而杀伤宫颈癌细胞。但是,由于存在器官、组织和细胞屏障,单独质粒并不能穿透这些屏障进入细胞质,甚至有可能引起核酸降解或DNA双链断裂,因此,需要有合适的载体保护基因药物免受体内酶类和细胞内物质的破坏,使质粒DNA能有效进入细胞核内,发挥基因在胞核转录蛋白质的作用[8]。
由于CRISPR/Cas9质粒系统碱基数多,体积大,为有效递送CRISPR/Cas9质粒系统,华中科技大学同济医学院药学院谭松巍副教授课题组与中山大学附属第一医院妇产科胡争教授课题组合成了聚酰胺-胺(PAMAM)-聚(β-氨基酯)超支化共聚物(hPPC),并制备了hPPC-CRISPR/Cas9 质粒纳米复合物系统。该系统表现出优于PEI25kD和商业转染试剂HP的转染效率,能有效切割HPV阳性肿瘤细胞中的HPV病毒整合片段,降低HPV相关E7蛋白的表达,诱导凋亡蛋白RB1的表达,进而有效抑制肿瘤的生长。此外,研究揭示了拓扑结构对质粒转染的影响,支化度最高的hPPC1转染能力最强,线性PBAE次之,支化度低的hPPC2转染能力最低。因此,合成超支化共聚物作为一种新的基因转染材料,能够有效用于CRISPR/Cas9基因编辑系统的递送,并显示出了较好的抗肿瘤效果和良好的生物安全性,为CRISPR/Cas9基因编辑系统在病毒感染相关肿瘤的治疗提供了临床应用思路。
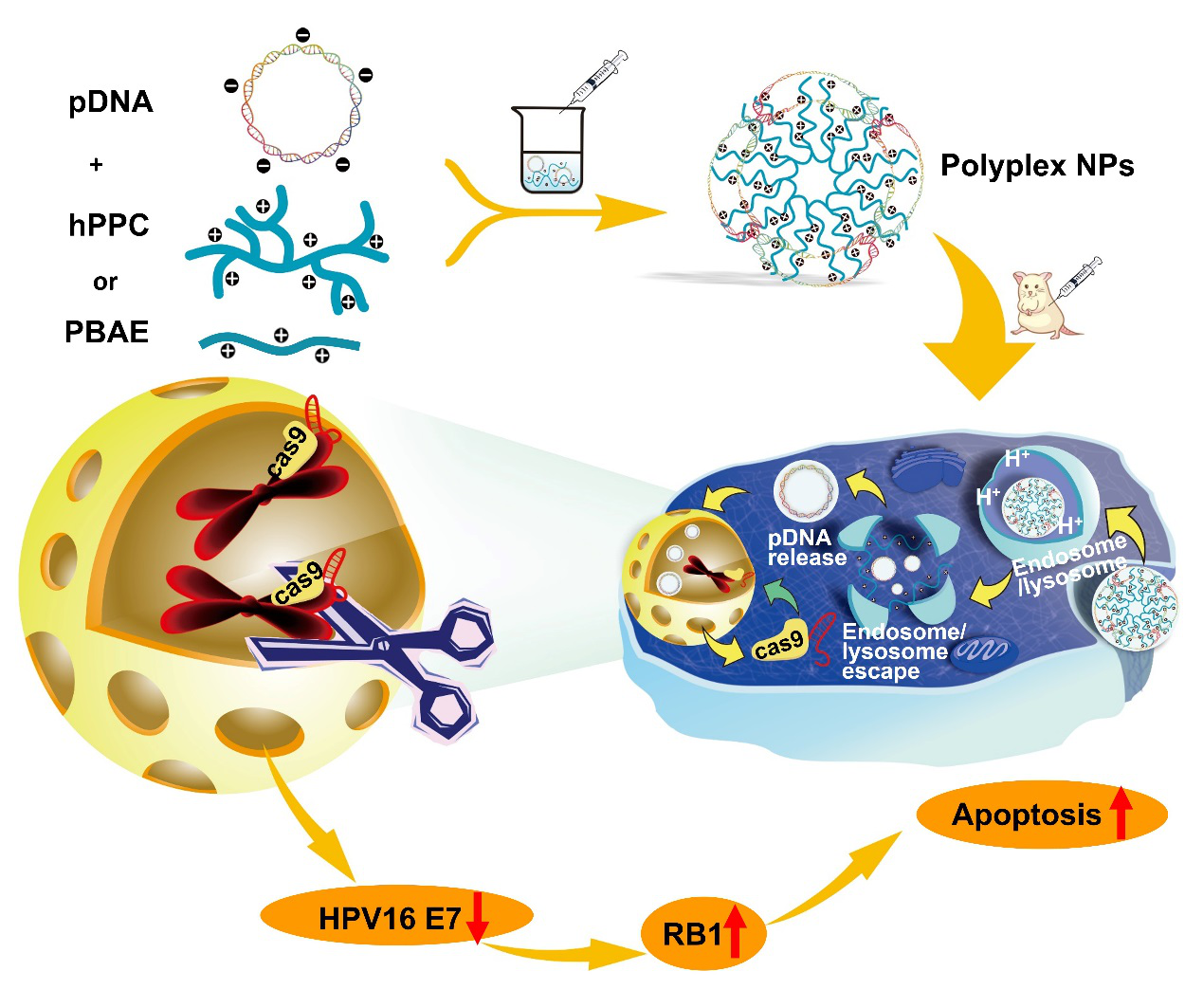
图1. 纳米粒的制备及HPV感染相关宫颈癌治疗机制示意图
该研究成果以题为”Hyperbranched poly(β-amino ester) based polyplex nanopaticles for delivery of CRISPR/Cas9 system and treatment of HPV infection associated cervical cancer”,发表在《Journal of Controlled Release》2020年第321期上。
本文第一作者为华中科技大学同济医学院附属协和医院药剂科高雪琴硕士、中山大学附属第一医院妇产科博士生金庄以及华中科技大学同济医学院附属同济医院妇产科硕士生谭项宇,通讯作者为华中科技大学同济医学院药学院谭松巍副教授和中山大学附属第一医院妇产科胡争教授。
文章信息:Xueqin Gao, Zhuang Jin, Xiangyu Tan, Chong Zhang, Chenming Zou, Wei Zhang, Jiahui Ding, Bhudev C. Das, Konstantin Severinov, Inga Isabel Hitzeroth, Priya Ranjan Debata, Dan He, Xin Ma, Xun Tian, Qinglei Gao, Jun Wu, Rui Tian, Zifeng Cui, Weiwen Fan, Zhaoyue Huang, Chen Cao, Yuxian Bao, Songwei Tan, Zheng Hu. Hyperbranched poly(β-amino ester) based polyplex nanopaticles for delivery of CRISPR/Cas9 system and treatment of HPV infection associated cervical cancer. Journal of Controlled Release, 2020, IF= 7.901.
参考资料:
[1] F. Bray, J. Ferlay, I. Soerjomataram, R.L. Siegel, L.A. Torre, A. Jemal. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (2018) 394-424. https://doi.org/10.3322/caac.21492.
[2] S.A. Francis, J. Nelson, J. Liverpool, S. Soogun, N. Mofammere, R.J. Thorpe, Jr. Examining attitudes and knowledge about HPV and cervical cancer risk among female clinic attendees in Johannesburg, South Africa. Vaccine. 28 (2010) 8026-8032. https://doi.org/10.1016/j.vaccine.2010.08.090.
[3] W.C. Phelps, C.L. Yee, K. Münger, P.M. Howley. The human papillomavirus type 16 E7 gene encodes transactivation and transformation functions similar to those of adenovirus E1A. Cell. 53 (1988) 539-547. https://doi.org/10.1016/0092-8674(88)90570-3.
[4] C.A. Moody, L.A. Laimins. Human papillomavirus oncoproteins: pathways to transformation. Nat Rev Cancer. 10 (2010) 550-560. https://doi.org/10.1038/nrc2886.
[5] A. Ciavattini, N. Clemente, G. Delli Carpini, C. Gentili, J. Di Giuseppe, P. Barbadoro, et al. Loop electrosurgical excision procedure and risk of miscarriage. Fertil Steril. 103 (2015) 1043-1048. https://doi.org/10.1016/j.fertnstert.2014.12.112
[6] A. Hildesheim, R. Herrero, S. Wacholder, A.C. Rodriguez, D. Solomon, M.C. Bratti, et al. Effect of human papillomavirus 16/18 L1 viruslike particle vaccine among young women with preexisting infection: a randomized trial. JAMA. 298 (2007) 743-753. https://doi.org/10.1001/jama.298.7.743.
[7] S.W. Cho, S. Kim, J.M. Kim, J.S. Kim. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nat Biotechnol. 31 (2013) 230-232. https://doi.org/10.1038/nbt.2507.
[8] R.J. Cristiano. Targeted, non-viral gene delivery for cancer gene therapy. Front Biosci. 3 (1998) D1161-1170. https://doi.org/10.2741/a352.
- 美国圣母大学高海峰教授课题组:基于层状分段超支化共聚物的人工光捕获体系取得重要进展 2017-12-07
