杜永峰1,于铭2,闫烨1
(1. 西安理工大学理学院应用化学系,陕西西安710048; 2. 第四军医大学西京医院超声科,陕西西安710032)
Advances in the materials of microbubble unltrasound contrast agents
DU Yong-feng1, YU Ming2, YAN Ye1
(1. Department of Applied Chemistry, School of Sciences, Xi’an University of Technology, Xi’an 710048, China;
2. Ultrasound Division, Xijing Hospital, Fourth Military Medical University, Xi’an 710032, China)
Abstract:Ultrasound contrasta agents (UCA)are a new kind of diagnostic drugs which can greatly enhance the medical ultrasound signals. The presence of UCA opens a new field in non-damaging ultrasound medical examination. In this paper, materials used in the present UCA are reviewed. According to their different membrane materials, some new UCA are introduced from the viewpoints of preparation. Potential combinations of UCA with targeted drug delivery system are simply summarized. Besides, some relevant results obtained by us are also introduced.
Key words:ultrasound contrast agent;microbubble;ultrasound imaging;targeted drug delivery system
摘要:超声造影剂(UCA)是一类能够显著增强医学超声检测信号的诊断药剂,UCA的出现,开创了无创超声医学的一个新领域。本文对目前应用于微泡超声造影剂的各种材料进行了评述,并按膜材料的不同,从制备角度出发介绍了一些最新的造影剂,介绍了微泡超声造影剂目前在靶向制剂领域的融合,文中还介绍了我们开展的一些工作。
关键词:超声造影剂;微泡;超声成像;靶向制剂
中图分类号:TQ423.9 文献标识码:A
文章编号:1001-9731(2004)增刊-2473-04
1 引言
超声造影剂(ultrasound contrast agent, UCA)是一类能够显著增强医学超声检测信号的诊断药剂,在人体微小血管和组织灌注检测与成像方面,使用UCA进行超声检测具有成像效果好、实时、操作简便、无离子辐射、无损性、适用面广等优点,因此在医学临床检测中得到了越来越多的应用[1~3]。超声成像基于回波信号的反射强度,微泡具有较强的回波反射性能,目前被认为是最好的人体微管内的造影材料。以微泡制成的超声造影剂称为微泡型超声造影剂(microbble ultrasound contrast agents, mUCA),现在作为声学造影剂应用的一般均是微泡型的造影剂,因此微泡型超声造影剂可简化称为UCA。UCA的出现,开创了无创伤超声医学的一个崭新的领域,除了作为超声诊断药剂之外,近年来还发现UCA具有分子成像、促进血栓溶解、促进基因转染及药物体内运输定点释放等作用[4~7],这使得UCA也成为目前医学领域的一个研究热点。
近几年来,国外UCA的制备及其应用研究十分活跃,而国内UCA的制备研究基本以声空化人血清白蛋白为主,其研究及应用基本停留于国外上个世纪90年代初的水平,并且国内目前还没有UCA的生产厂家,而国外生产的各种UCA都过于昂贵, 一瓶一百多美元的UCA只能用于一次超声造影。越来越多的研究显示,UCA目前已成为医学超声检测上必不可少的诊断药剂,UCA在其它医学领域还显示着许多诱人的应用前景,因此在我国研究开发UCA的制备技术具有巨大的研究和实际应用价值。UCA的发展经历了早期的以实验用生理盐水、染料、胶体、乳液和含有自由气泡的液体为代表的第一代声学造影剂,以包裹室内空气的人血清白蛋白微泡为代表的第二代声学造影剂。1993年由于新的发现,微泡的气体材料得到了重视,1995年后,出现了以全氟化碳等高分子量气体作为微泡内的填充气体,自此形成了第三代稳定微泡超声造影剂。目前,UCA正在向具备有靶向诊断(包括分子成像)、靶向载药的第四代功能性声学造影剂方面发展。
2 微泡造影剂的包膜材料
1972年Ziskin[8]发现造影效果是由液体中的气体形成的气泡导致的,因此他认为造影效果是由所选液体的物理化学性质决定的,当然这一结论目前看来并不完全正确。受Ziskin的影响,人们后来开始尝试采用各种液体介质作为微气泡的膜,如生理盐水、右旋糖苷、山梨醇、胶体溶液、人血清白蛋白等。目前,已有多种材料被用来作为微泡的膜,这里我们将其分类介绍如下,同时按照主要膜材料的不同分别介绍目前最新研究和应用的微泡超声造影剂。
2.1 表面活性剂类
由于表面活性剂本身的特性,目前已制备出的超声造影剂中大都或多或少含有一些表面活性剂成份,如AF0150中就含有少量的表面活性剂,AF0150 是美国Alliance制药公司生产的微泡超声造影剂,AF0150是采用干燥方法制成的粉体,粉体其中含有表面活性剂、盐、缓冲物质,粉体以全氟化碳气体饱和并储存在密闭小瓶中,使用时注入无菌水就会形成微泡,微泡平均尺寸5μm,浓度5×108个/ml[9]。目前的ST系列造影剂的膜材料是基于表面活性剂的,这里,S指的是Span类表面活性剂,T指的是Tween类,Span类和Tween类均为非离子表面活性剂。ST系列中常见的是ST44 和ST68,ST44 采用Tween40 和Span60,ST68采用Span60 and Tween80,微泡中的气体已采用的有空气、全氟丁烷和六氟化硫。大部分基于表面活性剂微泡的制备方法可以采用声空化、冷冻干燥、热气流干燥等。ST68平均直径为3.8μm,浓度为7.1×108/ml, ST68在4~6周内微泡浓度无明显变化。Wheatley等发现稳定的表面活性剂微泡组成中一般包含一种液态表面活性剂和一种固态表面活性剂,此外,Span类表面活性剂仅Span40和Span60能和Tween类除Tween85之外的其它Tween类表面活性剂形成稳定微泡,从HLB值上来说,稳定微泡的组成成分里需要含一种HLB>10.5的表面活性剂和一种HLB<9的表面活性剂[10]。
2.2 蛋白质类
蛋白质类物质以人血清白蛋白用于超声造影剂的研究及临床应用最多,制备方法采用声空化法,白蛋白浓度取为5%。在蛋白质中加入一些助剂,可以显著提高蛋白质微泡的性能,文献[11]中介绍在蛋白质中加入蔗糖形成的气泡分散性好,而且在加热的情况下也不破裂,基于这一结果,我们将其用于制备造影剂微泡,通过在5%人血清白蛋白中加入40%蔗糖,并通入全氟丙烷气体,制得了十分稳定的白蛋白微泡[12]。也有研究者在蛋白质中加入葡萄糖及右旋糖酐来改善微泡性能。美国Molecular Biosystems公司生产的Albunex是最早上市的微泡超声造影剂,该公司近来还开发出了Optison微泡造影剂,Optison采用1%人血清白蛋白,包裹的气体是全氟丙烷[13]。Porter TR和Xie F 等开发的PESDA为声空化50%右旋糖苷、5%人血清白蛋白,微泡内气体为全氟化碳,据其报道可以实现较好的心肌显影,PESDA浓度为5×109~6×109个/ml,平均直径4.7±0.3μm[14]。
2.3 脂类物质
脂类物质尤其是脂质体作为UCA膜材料的研究近年来也较多一些。脂类形成的UCA膜可以分为两种:一种膜中的脂质分子为单层排列;另一种膜中的脂质形成类似于细胞膜的双分子层结构。脂类UCA一般均较稳定,放置时间也较长。脂质体是当两亲分子如磷脂分子分散在水中时,能自发形成磷脂双分子包裹溶液的球形封闭小囊泡,即为脂质体。脂质体的粒径一般在几十个纳米到几个微米之间。以脂质体通过化学修饰可以制成具有靶向功能的微泡造影剂,在特定的器官部位聚集,实现对该部位的最佳造影效果。一般来说,饱和脂质体作为微泡膜要比不饱和脂质体好一些,因为饱和脂质体在生理温度下以凝胶形式存在而不饱和脂质体以液晶形式存在。凝胶状态的脂质体内部烷基基团的排列要比液晶形式存在的脂质体紧密得多,因此做成的膜使气体分子更难以渗透通过。如二棕榈酰磷脂酰胆碱为一烷基上有16个碳原子的饱和磷脂,其相变温度为42℃,生理温度下则以难被气体透过的凝胶形式存在[15,16]。德国ByK Gulden 公司开发的BY963以3-磷脂酰-甘油基-二硬脂酰的钠盐为膜材料,该材料类似于生物细胞膜的基本成分,即含硬脂酸的饱和磷脂。
2.4 聚合物
聚合物作为微泡UCA的膜材料是因为分子间的作用力较强,从而使膜的稳定性较高。聚合物一般需要通过交联的方法来制备微泡液膜,在UCA中已采用的高分子材料有聚乙二醇4000、聚丁基-2-氰基丙烯酸酯、多聚糖、海藻酸盐等。聚合物膜可以做得非常薄,如以聚丁基-2-氰基丙烯酸酯为微泡膜时的厚度接近100nm,而且膜的弹性好,形成的微泡非常稳定,能够忍受巨噬细胞的吞噬,从而实现淋巴等部位的被动靶向造影[17]。瑞士Bracco Research公司采用冻干法制备出聚乙二醇的空心干粉,再与六氟化硫混合物密封保存,开发出了BR1微泡超声造影剂,该造影剂使用时同其它干粉剂一样,需加入无菌水,即得到微泡。Sonus公司生产的气液相变型造影剂Echogen,采用了表面活性剂微乳化非离子聚合物和2.2%全氟戊烷异构体混合物,乳化液滴的直径为0.2μm,在29℃下,全氟戊烷由液体转变为气体,形成的微泡的体积较原来液滴增大2.8倍,在生理温度下,微泡直径进一步增大达到2~3μm,成为超声波的强反射体。
2.5 糖类物质
基于糖类物质的微泡超声造影剂一般均具有很好的安全性和生物相容性。多聚糖如淀粉可被加入到一些配方中用来提高微泡的稳定性,因为加入淀粉可以增强微泡膜分子之间的作用力。单糖和寡聚糖分子较小,相互作用力不强,形成微泡的方法不同于淀粉等多聚糖,单糖和寡聚糖用来制备微泡时采用了气泡形成的基本物理原理[18]:在任何被气体过饱和的液体中,气泡首先在液体中的一些固体表面形成,如容器表面和分散在液体中的糖类物质的固体粉末位点,而且形成的气泡可以存在很长时间。采用这一原理制备出的微泡尺寸分布集中,微泡也有足够的存在时间。德国Schering AG公司开发出了两种基于半乳糖的微泡超声造影剂Echovist和Levovist, 这两种造影剂均是首先通过干燥的方法制成粉末,使用时将定量的粉末与水溶液混合,然后剧烈摇动数秒钟,这些粉末会首先会分散成更小的微粒,这些微粒则会成为微泡形成的位点,最后形成了的溶液每ml含有200~400 mg的微泡。微粒的尺寸决定了围绕其形成的微泡的尺寸,形成的微泡溶液约2min后达到平衡,随后可以保持约10min的超声回波能力。Echovist 和Levovist 化学组成基本相同,只是Levovist成分中多了0.1%的棕榈酸,这一少量的棕榈酸显著增强了Levovist微泡的稳定性,使其可以通过肺循环而进入动脉循环。这些造影剂静脉注射后,微泡附着的半乳糖微粒会溶解,微泡则继续存在,形成回波加强了的血流。
3 微泡超声造影剂及其造影效果
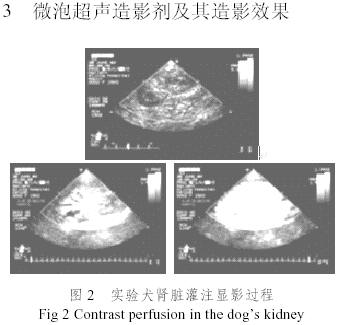
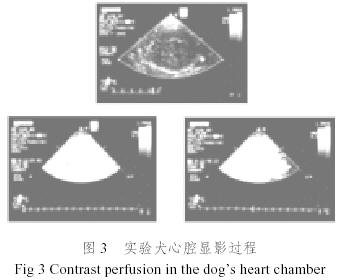
图1时我们采用表面活性剂及其助剂制备的微泡超声造影剂显微图片(×100),微泡平均直径3.95μm,微泡浓度3.6x109个/ml[19,20]。

图2是我们采用图1所示的微泡造影剂进行的试验犬肾脏血流灌注造影实验结果,图3是试验犬心腔造影实验结果,从图2和图3可以清晰看出微泡超声造影剂的造影效果。
4 微泡超声造影剂与靶向制剂
利用靶向分子导向一直是非常活跃的一个研究领域,但由于目前对生物体本身各类生化作用的特异性还远缺乏了解,这对该方法的应用产生了一个目前仍然无法克服的瓶颈效应。采用在微米微泡及亚微米或纳米载药微球膜上分别引入能发生相互作用的分子或基团,然后将微泡与微球载药体按一定比例连接,静脉注入体内后,在特定组织部位通过超声引爆微米微泡,利用微泡崩溃时产生的能量将周围连接的微球击碎,从而达到药物及微泡的靶向运输与控制释放的目的,这一过程可以同时实现造影与释药,即同时实现诊断与治疗的目的。由于不涉及体内的生化反应,而微泡与微球的连接很容易通过一些化学方法实现如羧基与氨基之间的作用等,此外由于体外超声引爆微米微泡的无损性、安全性和可控性在微泡超声造影剂的应用中已得到广泛证实,因此认为这一方案可能会成为今后较短时期内靶向给药及控制释放的突破点。除了可以在微泡表面接入载药微球之外,也可在微泡制备时将药物包裹在微泡中,形成同时包裹药物和气体的载药载气的微泡体,如果在内部包裹药物的表面接入靶向分子,则可以实现微泡定向引爆和靶向分子导向的双重靶向作用。
参考文献:
[1] Lindner, Jonathan R. Detection of inflamed plaques with contrast ultrasound. [J]. The American Journal of Cardiology Volume, 2002, 90(10): L32-L35.
[2] Hohmann J, Albrecht T, Hoffmann C W, etc. Ultrasono- graphic detection of focal liver lesions: increased sensitivity and specificity with microbubble contrast agents. [J]. European Journal of Radiology, 2003, 46: 147-159.
[3] Esteban J M, Molla C, Tomas L. Improved detection of liver metastases with contrast-enhanced wideband harmonic imaging: comparison with CT findings. [J]. European Journal of Ultrasound, 2002, 15: 119-126.
[4] Christiansen Jonathan P,Brent A. Alexander L. etc. Targeted tissue transfection with ultrasound destruction of plasmid-bearing cationic microbubbles. [J]. Ultrasound in Medicine and Biology, 2003, 29(12): 1759-1767.
[5] Shin-ichiro Miura, Katsuro Tachibana, Takahiro Okamoto, etc. In vitro transfer of antisense oligodeoxynucleotides into coronary endothelial cells by ultrasound. [J]. Biochemical and Biophysical Research Communications, 2002, 298: 587-590.
[6] Gawiyou Danialou, Alain S, Roy W R, et al. Ultrasound Increases Plasmid-Mediated Gene Transfer to Dystrophic Muscles without Collateral Damage. [J]. Molecular therapy, 2002, 6(5): 687-693.
[7] Evan C Unger, Thomas P McCreery, Robert H Sweitzer, etc. In Vitro Studies of a New Thrombus-Specific Ultrasound Contrast Agent. [J]. The american journal of cardiologyt, 1998, 81(12A): 58g-61g.
[8] Ziskin MC, Bonakdapour A, Wienstein DP, et al. Contrast agents for diagnostic ultrasound. [J]. Invest Radiol. 1972, 7:500.
[9] Christian Veltmann, Stefan Lohmaier, Thomas Schlosser, et al. On The design of a capillary flow phantom for the evaluation of ultrasound contrast agents at very low flow velocities.[J]. Ultrasound in Med. & Biol., 2002, 28(5): 625-634.
[10] Wheatley M A, Singhal S. Structural studies on stabilized microbubbles: development of a novel contrast agent for diagnostic ultrasound. [J]. Reactive polymers, 1995, 25: 157-166.
[11] 北原文雄. 表面活性剂[M]. [孙绍增译]. 北京: 化学工业出版社, 1984.第48-49页.
[12] 杜永峰, 万明习, 赵文明. 含蔗糖白蛋白包膜微泡超声造影剂制备研究. [J]. 药学学报, 2001,36 (11): 859-862.
[13] Moran C M, Watson R J, Fox K A A, et al. In vitro acoustic characterisation of four intra- venous ultrasonic contrast agents at 30 mhz. [J]. Ultrasound in Med. & Biol., 2002, 28(6): 785-791.
[14] Porter T, Kricsfeld D, Cheatham S, et al. Effect of blood and microbubble oxygen and nitrogen content on perfluoro- carbon-filled dextrose albumin microbubble size and efficacy: in vitro and in vivo studies. [J]. J Am Soc Echocardiogr. 1998,11(5): 421-425.
[15] Lanza GM, Wallace KD, Scott MJ, et al. A novel site-targeted ultrasonic contrast agent with broad biomedical application. Circulation. [J]. 1996,94(12): 3334-3340.
[16] Alkan-Onyuksel H, Demos Sm, Lanza GM, et al. Develop- ment of inherently echogenic liposomes as an ultrasonic contrast agent. [J]. J Pharm Sci. 1996,85(5): 486-490.
[17] Dugstad Harald, Foss Per Antonius, Klaveness Jo, et al. Polymeric surfactant-encapsulated microbubbles and their use in ultrasound imaging. [P]. US Patent, No. 5,919,434, 1999.
[18] Barry B Goldberg. Ultrasound Contrast Agents.[M]. Published by Martin Dunitz Ltd (United Kingdom), 1997. p1-191.
[19] 杜永峰. 纳米包膜造影微泡: 设计与实验. [D]. 西安交通大学博士论文, 2003.6.
[20] 杜永峰, 万明习, 王素品, 等. 基于表面活性剂的纳米包膜微泡超声造影剂研究. [J]. 化工学报, 2003, 54(6): 807-812.
作者简介:杜永峰(1970-),男,西安人,博士,西安理工大学副教授,目前主要研究方向为新型微纳米微泡超声造影剂及其用于超声诊断和分子成像的研究。E-mail: maildyf@yahoo.com.cn Tel: 029-82312770
论文来源:中国功能材料及其应用学术会议,2004年,9月12-16日