王卫平 吕功煊
(中国科学院兰州化学物理研究所 羰基合成与选择氧化国家重点实验室 兰州 730000)
一、引 言
能源与环境是未来人类社会可持续发展涉及的最主要问题。目前, 全球 80% 能量需求来源于化石燃料, 这最终必将导致化石燃料的枯竭, 而其使用也导致严重的环境污染, 从化石燃料逐步转向利用可持续发展、无污染的非化石能源是发展的必然趋势。氢能是理想的清洁能源之一, 也是重要的化工原料,在加氢反应(煤的液化和汽化、重油的重整等)、阻氧剂、内燃机燃料、制冷剂制造等方面都大量使用。氢气若直接用于内燃机的燃料, 可获得比一般碳氢化合物燃料更高的效率, 而且还具有零污染排放的优异性能; 将氢气用于氢氧燃料电池则可得到高达 45% —60% 的化学能2电能转化效率, 而一般内燃机的热机效率仅为 15%。近年来, 由于质子交
换膜燃料电池(PEM FC)技术的突破, 高效燃料电池动力车样车已陆续出现。随着技术的不断发展, 氢能的应用范围必将不断扩大, 大力开发氢能具有重大意义。
工业上大量生产氢气的方法是用水蒸汽通过灼热的焦炭, 生成的水煤气经过分离得到氢气, 电解水或甲烷与水蒸汽作用后生成的物质经分离也可以得到氢。随着对氢能越来越大的需求, 近年来又开发出多种新的制氢方式(如表 1)。
在 21 世纪, 氢的需求量将持续增加, 最主要的应用可能是燃料电池和燃料电池电动车。燃料电池通过补加燃料实现连续运转, 尤其适用于偏远隔绝的地方。这种装置体积小、效率高、排污很少, 主要产物是水。然而, 燃料电池商业化还存在巨大的障碍,即氢的储存与配给的问题。现有的工业方法无法避免这一困难, 表 1 列出的各种方法亦存在同样问题。解决这些问题的有效办法之一就是通过合适的具有高能量密度的液体燃料的催化转化即时产生氢气。

在所有可能利用的液体燃料中, 低碳醇如甲醇和乙醇以其含氢量高、廉价、易储存、运输方便而成为最佳选择 。国外已出现基于甲醇或乙醇作为 催化制氢液体燃料的高效燃料电池动力车样车 。
甲醇和乙醇理论上都可以通过直接裂解、水蒸汽重整、部分氧化、氧化重整等方式转化为氢气。甲醇催化制氢的研究已经受到广泛的关注, 相对而言,乙醇催化制氢的研究则还没有受到足够的重视, 难度大, 已有的积累仅限于热力学理论分析和催化剂与反应的初步探索。
从长远观点看, 生物质发酵法生产乙醇必将成为主流。生物质在成长过程中能够吸收大量的二氧化碳, 尽管乙醇生产、制氢也放出二氧化碳, 但是整个过程形成一个碳循环, 不产生净的二氧化碳排放。另外, 乙醇无毒、不含易使燃料电池铂电极中毒的硫、易于储存和运输。因此由乙醇催化制氢必将是一种很有前景的方法。
二、乙醇催化制氢的可能途径
乙醇可能通过以下几种方式转化为氢气:
a. 水蒸汽重整(steam refo rm ing)

b. 部分氧化(partial oxidation)

三、热力学分析
目前, 乙醇催化制氢的主要工作来自于阿根廷、巴西、印度等农业大国, 以乙醇水蒸汽重整制氢反应研究为主, 而且其中近一半的工作仅从热力学上对反应进行分析, 还未涉及到乙醇制氢的动力学过程和反应机理。乙醇水蒸汽重整制氢的显著优点是原料可以用乙醇含量为 10v v% 左右的水溶液, 可直接从工业得到不需蒸馏浓缩。
乙醇催化制氢研究始于 1991 年, 由 Garcia 和L abo rde 等率先从热力学角度对这一反应的可行性及气相产物的分布进行了计算, 指出高温、低压和高水乙醇比例的条件有利于提高氢气的产率和选择性, 同样高温和低压也有利于CO 的产生, 而甲烷因其与氢气竞争氢原子, 导致氢气的选择性降低, 是不希望的副产物。V asudeva 等在前人工作的基础上作了进一步发展, 考察了反应中碳的形成机制;
F reni 等和 F reni 及M aggio]提供了乙醇水蒸汽重整反应在M CFC (熔融碳酸盐燃料电池) 中的应用(基于 IIR)方式。1998 年,M aggio 等通过计算指出在低温下内部重整制氢可成功应用于M CFC,这为乙醇、甲醇和甲烷作为燃料用于M CFC 奠定了技术基础。通过比较分析他们得出结论: 若考虑乙醇、甲醇和甲烷的能量密度, 及每种原料的化学、电化学和热力学方面的参数, 综合考虑经济和环保方面, 乙醇相对其它燃料表现出更大优势, 因为乙醇能量密度高、易储存和毒性低, 用于燃料电池可获得较大电池电压及电能密度。
乙醇催化制氢不仅可以用于M CFC 中, 还能用于固体聚合物燃料电池(SPFC) 中。 Ioannides 曾讨论了乙醇用于 SPFC 的热力学。作者认为乙醇转化过程可分为乙醇的重整、部分氧化、水气转换以及一氧化碳的氧化等若干个过程, 并讨论了各个过程对产氢速率的影响, 发现影响乙醇重整产氢速率的最重要因素是进料气中水和乙醇的比例(R 值), R值高时水汽化所需的热量就多, 从而降低产氢的效率, 计算得最佳的 R 值等于 213, 即相当于大约4165 mo l 水 1 mo l EtOH 的水溶液。乙醇水蒸汽重整反应是吸热反应, 反应可用燃料电池排出的废气作为燃料提供反应所需的热源。但是水蒸汽重整反应装置复杂, 需要外界供热的问题一直困扰着该技术的实际应用。近年来, 一种新型的乙醇催化制氢反应工艺发展出来, 即乙醇部分氧化制氢。乙醇部分氧化反应具有启动快和反应快的优点, 其反应温度可依据进料气的预热温度来确定, 某些低温催化剂甚至可以在 500 K 左右工作。另外催化部分氧化较水蒸汽催化重整要安全可靠, 并且出口氢气的浓度可以调节。
四、乙醇催化制氢催化剂研究状况
具有高活性、高选择性、高稳定性的催化剂在乙醇催化制氢过程中起重大作用。乙醇的水蒸汽重整制氢使用的催化剂体系还比较有限, 主要为 Cu 系催化剂, 贵金属和其它类型催化剂。
11 Cu 系催化剂
Cu 系催化剂广泛应用于甲醇合成和甲醇催化制氢反应, 并表现出优越的催化性能。由于乙醇和甲醇有着某些共性, 因此乙醇催化研究首先围绕Cu 系催化剂展开。
M arino 等[10, 29 ]研究了 Cu N i K C2A l2O3 催化
剂乙醇水蒸汽重整反应的活性, 系统考察了 Cu 担载量、N i 含量及焙烧温度对 Cu N i K C2A l2O3 催化剂结构和性能的影响, 认为: 在乙醇重整制氢的过程中, Cu 是反应活性组分, 并促进 C—H、O—H 键的断裂,N i 促进 C—C 键的断裂, K 仅中和载体 C2A l2O 3 的酸性而不改变催化剂的结构; 提高反应选择性的关键在于抑制C—O 键的断裂。通过XRD、TPR 和N O 化学吸附技术发现CuO 相的存在依赖2Cu 担载量和焙烧温度, 而N iA l2O 4 相在所有应用的催化剂中均存在。不同活性组分含量的Cu N i KC2A l2O 3 催化剂表现出相似的活性, 揭示了低的 Cu担载量有利于提高Cu 的分散度。另外N iCuCr A2A l2O 3 催化剂和 CuO ZnO A l2O 3 催化剂乙醇重整制氢的反应也有报道, 但结果都不理想。
2. 贵金属催化剂
贵金属催化剂在甲醇催化制氢反应中的研究比较多, 多为 Pd 系催化剂, 贵金属 Pd 和 Pt 担载型催化剂曾见用于乙醇的水蒸汽重整制氢, 但效果并不好[12 。贵金属Rh 担载型催化剂曾被用于以乙醇为反应物的内部间接重整M CFC 系统中, 载体用 A l2O 3, R h 的含量为 5%。但发现在较低的温度时催化剂几乎无活性, 仅仅是乙醇脱氢生成CO 和CH4;当温度高于 734 K 时乙醇水蒸汽重整制氢才有活性, 在 923 K, 反应达到热力学上平衡, 乙醇完全转化, 没检测到乙烯或乙醛。寿命实验表明在初始阶段活性有所降低, 随后趋于稳定, 可能是在反应初始阶段, 较高的反应温度致使催化剂中活性组分的分散度降低和颗粒的长大使活性降低。
31 其它催化剂
最近L lorca 等[6 研究了乙醇在一系列金属氧化物催化剂上的水蒸汽重整反应 (如表 2), 发现ZnO 具有很好的活性和较高的选择性, 产物中 CO含量极低, 特别适用于燃料电池。通过提高进样空速和反应温度, 获得了很高的产氢速率。ZnO 具有较好催化性能, 作者认为是由于 ZnO 既有碱性又有氧化还原性质的双重特性造成的。
考虑到N i La2O3催化剂在甲烷二氧化碳重整制合成气反应中表现出良好的催化性能siko stas 等 也将其用于乙醇的水蒸汽重整反应,并取得较好的结果。在温度低于 573K 时, 乙醇脱水生成乙醛和氢气, 随温度的升高, 乙醛选择性降低,相反乙醇水蒸汽重整反应逐渐占主要地位, 值得注意的是并没有观察到乙烯的生成, 可能归因于载体L a2O 3 不存在脱水反应所需的酸性位; 温度升高到823 K 时, CO 2 和CH 4 的选择性达最大值, 高于此温度, 甲烷和CO2、甲烷和水的重整反应在热力学上能够进行; 当温度达到 873 K 时, 乙醇的转化率达100% , 氢气的选择性超过 90% , 此时仅有的副产物是甲烷, 而含有少量甲烷的富氢气产物用于燃料电池是可行的, 因为甲烷和没反应完的氢气燃烧可给乙醇水蒸汽重整反应提供必需的热量。另外,N iL a2O 3催化剂还表现出良好的稳定性, 反应 150 h 活性和选择性仅有轻微的下降。不过, 此催化剂需在823 K 以上才有好的催化性能。
Cu 基催化剂易结碳且生成较多的副产物, 结碳原因主要是副产物乙烯存在造成的, 若把乙醇首先转化成其它的低结碳性中间产物如乙醛, 第二步仅把乙醛转化为富氢气, 就可避免或降低结碳量, 根据此原理 Freni 等提出了二段固定床反应器的概念。首先用 Cu SiO2 催化剂使乙醇脱氢生成乙醛, 温度控制在 643 K, 然后, 在N i M gO 催化剂作用下, 乙醛水蒸汽于923 K 下重整反应制氢。这种条件下, 乙醇转化率接近 100% , 氢的热平衡浓度接近58%。Galvita 等[28 发展了另一个重要的二段法, 将双层催化剂用于乙醇的水蒸汽重整反应, 第一段用的是 Pd C 催化剂, 目的是将乙醇裂解生成甲烷、氢气和含碳的氧化物; 第二段用的是N i 基 (GIA P:N i A l2O 32CaO)催化剂, 主要是将气相混合产物转化为合成气。第一段床层的反应温度是 335 K, 使乙醇完全转化, 第二段床层的反应温度是 923—1 073 K, 获得合成气。寿命实验发现乙醇转化率和氢的选择性都达到比较高的水平。

五、初步动力学
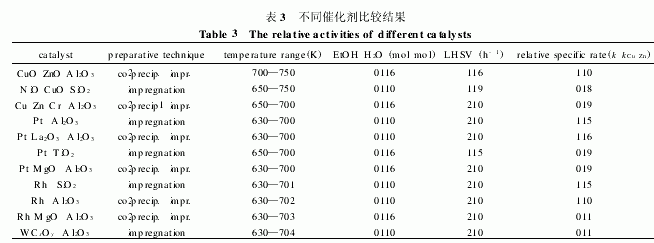
对于乙醇催化制氢的动力学方面, 仅有 Caval2laro 等[12 进行了初步动力学研究, 反应模型是乙醇]用于熔融碳酸盐燃料电池的水蒸汽重整反应。作者根据初始产物中甲烷的体积浓度不超过 3% , 而近似忽略甲烷的存在, 另外也不考虑含氧产物和碳的形成, 假设产物仅有CO、CO2 和 H2, 仅考虑乙醇的重整和水气转换反应等一系列假设, 提出一个动力学方程:
k = - LHSV log (1 - x )
其中 k 为表观反应速率( h - 1); x 为乙醇的转化率;LH SV 为液态乙醇的比空速(h- 1)。以此公式计算得出各催化剂对 Cu Zn A l2O3 催化剂的相对表观速率(如表 3 所示), 并由此得出结论: 贵金属催化剂表现出与 Cu Zn 催化剂相似或更差的催化性能, 而R h M gO A l2O 3和W CxO y A l2O 3 活性很差的原因是催化剂的烧结或W 物种被还原造成的。
六、总结与展望
综上所述, 尽管乙醇制氢在理论上有多种途径,但是研究得最多的还是水蒸汽重整制氢及其热力学分析; 催化剂类型也比较单一, 主要集中在Cu 基催化剂, 活性也并不理想; 对贵金属催化剂仅考察了R h 担载型催化剂, 然而该催化剂所需的反应温度也较高。对两种类型催化剂仅仅进行了初步研究, 还未涉及到深入反应动力学和反应机理。因此在今后的工作中, 对乙醇水蒸汽重整制氢反应应侧重以下两方面的研究: (1)丰富催化剂体系, 寻找有效且稳定的低温转化催化剂, 如以N i、Rh 等为主活性组分的催化剂; (2)建立反应动力学模型, 探索反应机理。
另外, 探索其他反应路线如乙醇的部分氧化制氢或将水蒸汽重整和部分氧化有效地结合起来也是重要的发展方向。和乙醇的水蒸汽重整相比, 乙醇部分氧化制氢为放热反应, 因而具有启动快、效率高、可自供热、便于小型化等诸多优点, 所以乙醇部分氧化制氢反应对于燃料电池电动车氢源的研究有重要意义, 将是今后发展的主要方向。
一般认为乙醇部分氧化制氢较甲醇部分氧化难度大, 目前尚未见有文献报道。中科院兰州化学物理研究所在乙醇的部分氧化制氢方面曾进行过一些尝试, 发现在乙醇催化制氢反应中起催化作用的是镍而非在甲醇催化制氢反应中普遍认为是活性组分的铜, 并发现N i2Fe 催化剂具有较好的催化性能,在较温和的条件下 (573 K) 乙醇的转化率达到8619% , 氢气的选择性达到 4612% 。从目前结果来看, 有可能用于乙醇部分氧化制氢的过程, 使乙醇制氢成为一种较有潜力的制氢方法。然而不论选择何种反应路线, 筛选出高效且稳定的低温催化剂将是最关键的问题。