西南大学陆飞副教授在国际知名期刊《Advanced Fiber Materials》上发表最新研究成果:Fiber-Reinforced Silk Microneedle Patches for Improved Tissue Adhesion in Treating Diabetic Wound Infections
Bio-road研发团队陆飞副教授在材料领域知名期刊《Advanced Fiber Materials》上发表最新研究成果

微针(MN)是一种长度为数十至数千微米的单针或阵列针,连接到基板上形成贴片。微针技术的出现不仅提供了一种新的药物输送方式,而且在生物传感器和医学诊断与治疗领域带来了许多新的可能性。随着该技术的深入研究和应用不断扩大,它逐渐成为生物医学领域的热点之一。
其中,水凝胶微针因具有材料选择灵活、生物相容性优良,可以有效输送亲水性药物等特点,有望成为实现创面完美修复的理想敷料。但现有的水凝胶微针常利用合成或改性高分子通过交联制得,工艺流程相对复杂;而天然高分子基水凝胶微针的穿刺力及其与创面的结合力较差,阻碍了其实际应用。因此,针对上述问题,迫切需要开发一种具有湿组织粘附性和较强力学性能的水凝胶微针。
近日,西南大学蚕桑纺织与生物质科学学院Bio-road生物医用材料研发团队在《Advanced Fiber Materials》(影响因子:17.2)上发表了题为“Fiber-Reinforced Silk Microneedle Patches for Improved Tissue Adhesion in Treating Diabetic Wound Infections”的研究成果(DOI: 10.1007/s42765-024-00439-z)。该成果报道了载有表没食子儿茶素没食子酸酯(EGCG)的纤维增强粘附微针贴片。通过引入甲酸-氯化钙二元溶剂体系制备了具有湿组织粘附性的丝素蛋白水凝胶微针,以壳聚糖纤维为增强相提高了微针的机械性能和粘度,从而增加了微针与组织的物理缠结和保持形状的能力。研究结果表明壳聚糖纤维的引入降低了微针所需的刺入力,且具有优异的抗氧化和抗菌性能,可以有效改善糖尿病伤口的愈合。
在这项研究工作中,作者利用甲酸-氯化钙溶剂体系溶解丝素蛋白,在溶液中引入载有EGCG的壳聚糖纤维,通过模板浇铸法,再经甲酸挥发和干燥成型后制得纤维增强的丝素蛋白微针(图1)。此外,从图中可以看出微针还可以被塑造成双面针和三角形等异形微针,更适用于异形伤口的粘附。
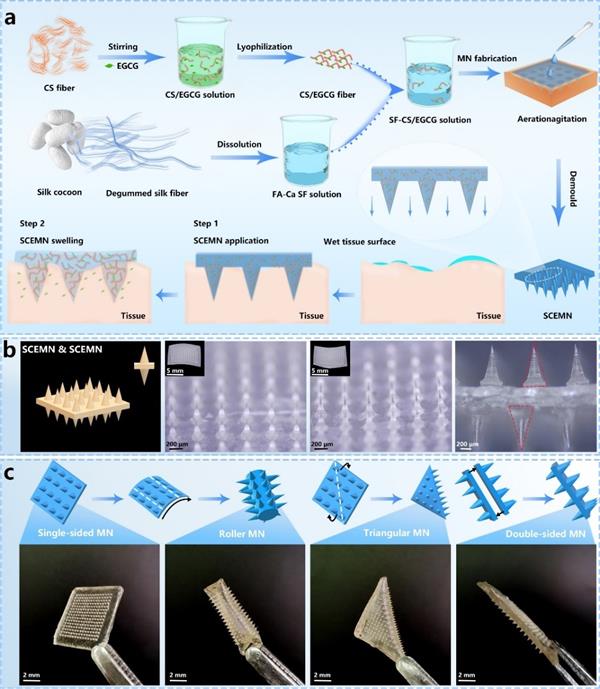
图1 纤维增强微针的制备工艺流程及显微形貌
通过红外光谱研究表明经过甲酸-氯化钙处理后,丝素蛋白分子链从规则排列的β-折叠结构转变为无规卷曲(图2a-d)。拉曼光谱证实干态丝素蛋白吸水成凝胶后无规卷曲含量进一步增加(图2e-h),无规卷曲结构的增多使得丝素蛋白大分子间的自由体积及氢键作用力减弱,有利于其与皮肤组织表面形成新的相互作用力。接着通过红外光谱和X射线光电子表面能谱测试表明了EGCG在壳聚糖纤维上的成功负载。流变实验证实了微针具有较好的自愈合性能。
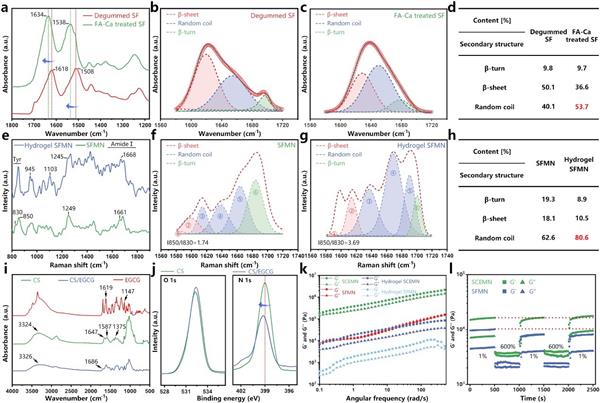
图2 微针的结构及流变性能表征
如图3a-b所示,通过显微镜观察了壳聚糖纤维在PBS中随时间的形态变化,结果显示当吸水时间达到10 min时,壳聚糖纤维的直径已经增长至初始直径的3倍(64 μm)。还构建了琼脂糖凝胶模型来实时监测微针的膨胀行为,可以看出壳聚糖纤维的引入提高了微针的溶胀程度。通过有限元模拟了纤维增强对丝素蛋白微针刺入皮肤行为的影响。实验和数值模拟结果均证实了壳聚糖纤维的引入降低了微针所需的刺入力。从有限元云图中可以看出丝素微针在刺入皮肤过程中针尖变形明显,导致微针与皮肤的接触面积增加,可能会进一步增加与周围组织的摩擦力,不利于微针刺入。而纤维增强微针在穿破皮肤角质层后仍然保持针体结构完整,说明壳聚糖纤维的引入赋予了丝素蛋白微针较好的机械强度。
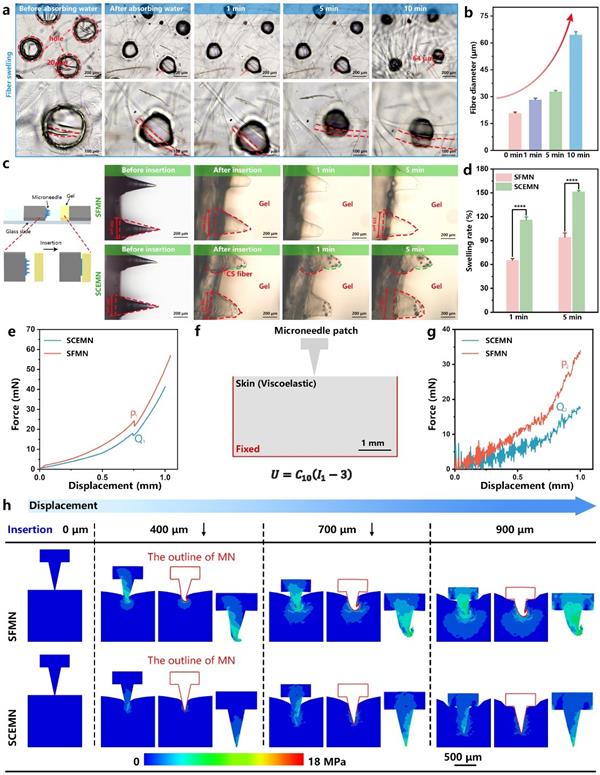
图3 微针的溶胀行为分析及有限元模拟
如图4所示,纤维增强微针的粘附机理包括两个方面:一是钙修饰丝素蛋白固有的物理粘附特性,钙离子通过金属螯合作用实现对丝素蛋白无规卷曲链的交联并作为水捕获点。基于此,初始干态的微针可通过钙离子从界面处捕获水分子,从而转变为更柔软水凝胶,实现与组织的紧密贴合。二是纤维增强介导的微针溶胀后与组织间的物理纠缠和机械互锁。微针在插入皮肤组织后可以快速吸收界面水,建立与湿润组织表面的接触,并在界面处形成物理相互作用。
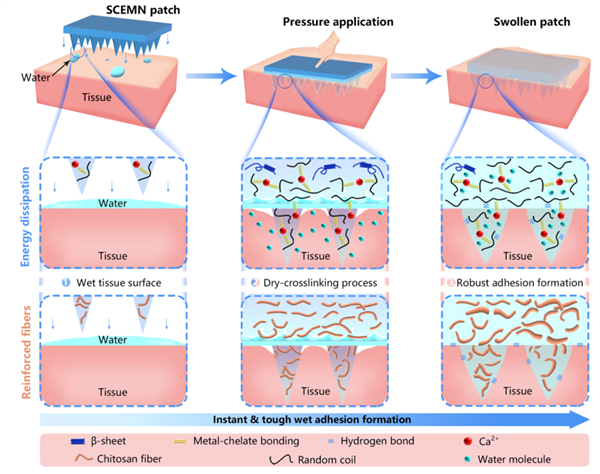
图4 微针的粘附机理
如图5所示,动物实验结果表明,与商业敷料相比,SCEMN能够更有效的改善糖尿病小鼠伤口愈合。病理组织学分析进一步证实,SCEMN处理的伤口再上皮化程度更高、胶原沉积较好。免疫荧光结果显示,在愈合前期,SCEMN能够调控M1型巨噬细胞向M2型巨噬细胞的转化,并调控巨噬细胞相关细胞因子的释放水平。
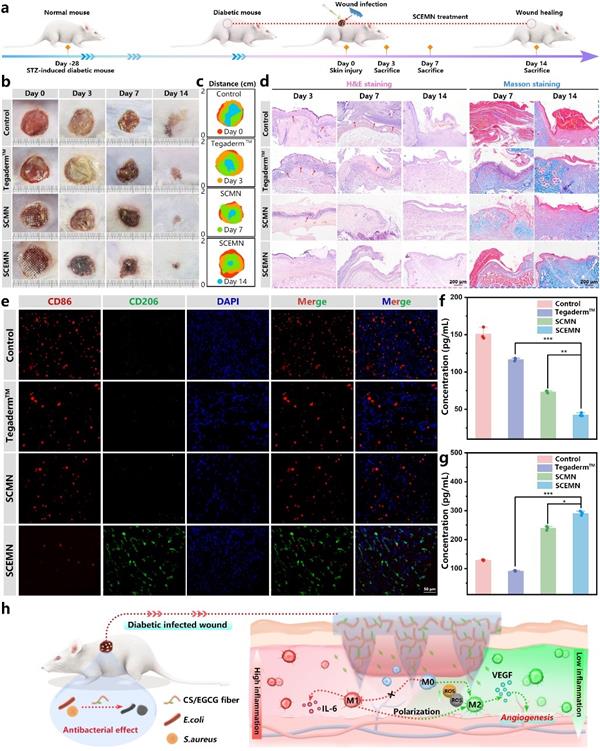
图5 微针的动物实验验证及病理学分析
西南大学蚕桑纺织与生物质科学学院2021级硕士研究生王义鑫为本文第一作者,西南大学陆飞副教授为本文的通讯作者。该研究得到了国家自然科学基金、重庆市自然科学基金的资助
Bio-road研发团队一直专注于针对创面止血与促愈用材料、体内溶栓药物载体的研究,近三年课题组成员共主持包括国防项目,国家自然科学基金,重庆市科技攻关项目,重庆市自然科学基金在内的10余项科研项目。在Advanced Functional Materials、Bioactive Materials、Chemical Engineering Journal等杂志上发表高水平SCI论文50余篇;已申请国家发明专利40项,其中已授权20余项。
本研究成果原文下载::
https://doi.org/10.1007/s42765-024-00439-z